PERISOLV®
Effizientes Biofilmmanagement

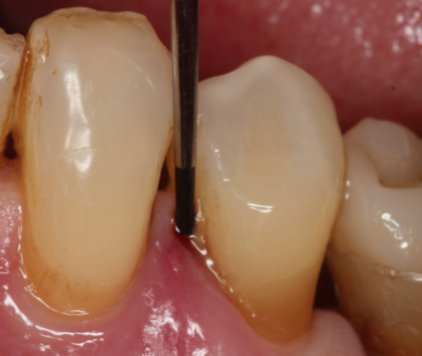
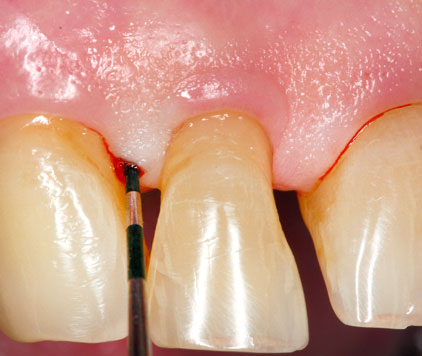
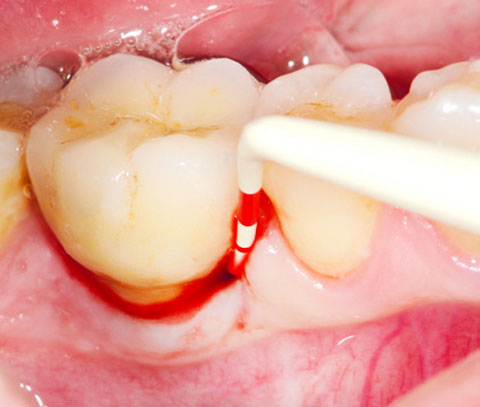
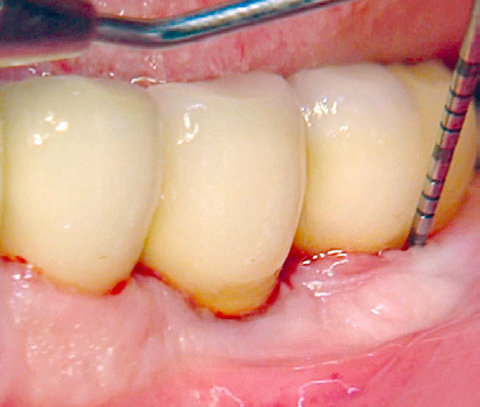
PERISOLV® ist ein bewährtes, wirksames und gut verträgliches Reinigungsgel auf Basis von Natriumhypochlorit (NaOCI), das durch verschiedene Aminosäuren gepuffert wird.
Es besteht aus 2 Komponenten:
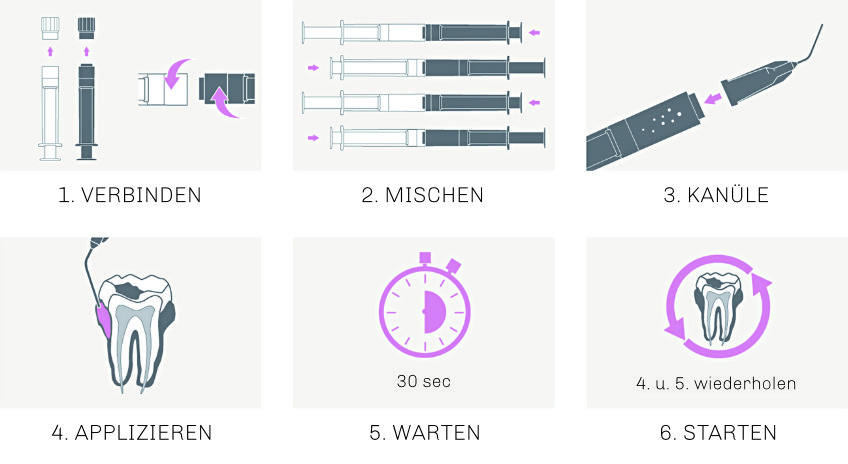
Vor Gebrauch werden beide Komponenten miteinander gemischt:
PERISOLV® zeichnet sich durch seine einfache Anwendung (schnelle Vorbereitung & kurze Einwirkzeit) aus.
VORTEILE
EFFEKTIVER
Unterstützt die Biofilmentfernung
EINFACHER
Erleichtert eine gründliche Reinigung der Wurzeloberfläche
SCHONENDER
Ermöglicht eine angenehmere Behandlung für Patienten
EINFACHE ANWENDUNG
Schnelle Vorbereitung und kurze Einwirkzeit
PRODUKTE
| Artikelnummer | Darreichung | |
| 0131.401 | 1 Box à 5 Portionen |
INDIKATIONEN
PERISOLV® für effektive nicht-chirurgische Instrumentierung
PERISOLV® kann bei folgenden Indikationen verwendet werden:
| INDIKATIONEN | PERISOLV® | |
| Adjuvante nicht-chirurgische Behandlung tiefer Taschen in der initialen Aktiven Infektiösen Therapie (AIT) bzw. "Full Mouth Desinfection" (FMD) |
 |
|
| Adjuvante nicht-chirurgische Behandlung tiefer persistierender Taschen in der Unterstützenden Parodontaltherapie (UPT) |
 |
|
| Adjuvante nicht-chirurgische Behandlung von Periimplant-Mukositis oder Periimplantitis |
 |
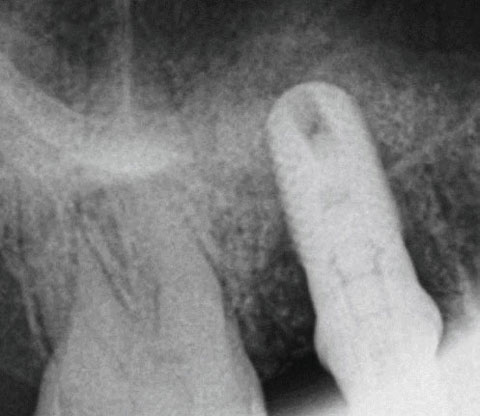
KLINISCHE EVIDENZ
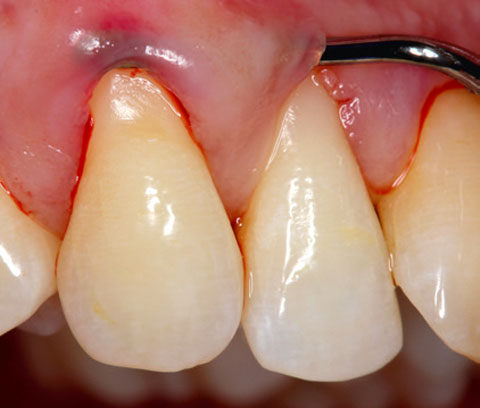
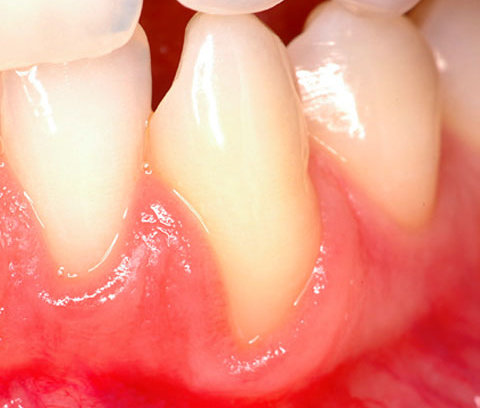
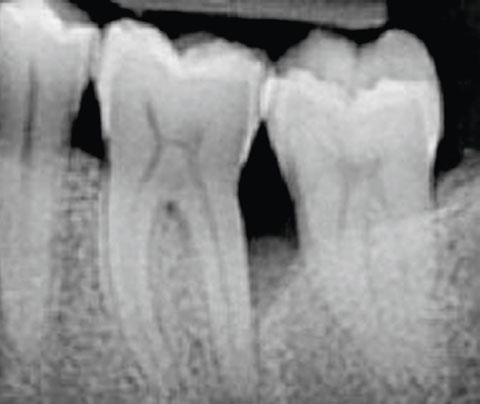
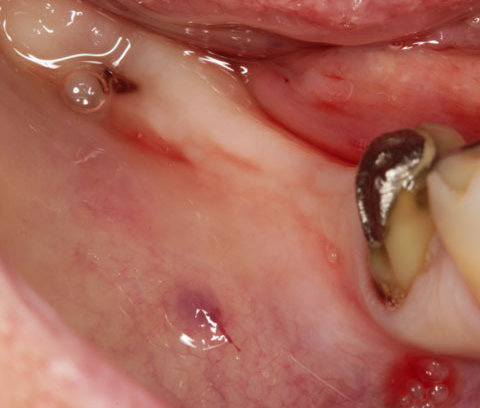
Adjuvante Behandlung einer persistierenden
entzündeten Zahntasche
Prof. Dr. Stefan Fickl
Deutschland
TECHNOLOGIE
Natriumhypochlorit und PERISOLV®
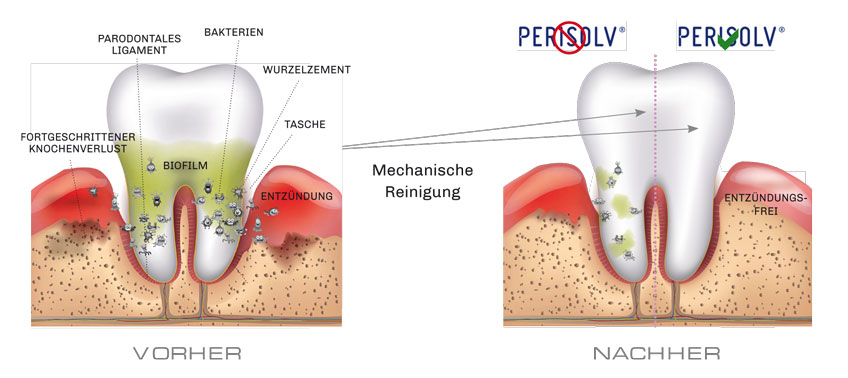
MODE OF ACTION
Mechanische Reinigung mit und ohne PERISOLV®
LITERATUR
- Data on file.
- Guarnelli ME et al. Professional local administration of chloramine-based treatment in conjunction with ultrasonic mechanical instrumentation: clinical outcomes in patients with deep periodontal pockets persisting following active non-surgical therapy. Minerva Stomatologia, April 2015; Vol. 64 suppl. 1 al No. 2: 158-159.
- Data on file.
* Fördert bei der mechanischen Reinigung die Entfernung der Bakterien.
DOWNLOAD-BEREICH
hyaDENT BG
Regeneration natürlich gefördert

hyaDENT BG stellt eine Behandlungslösung auf der Basis von Hyaluronsäure (HA) nichttierischen Ursprungs dar, die für regenerative dentale und parodontale Anwendungen optimiert wurde.
Die für hyaDENT BG verwendete HA wird biotechnologisch durch bakterielle Fermentation hergestellt. Dieser Prozess entspricht den höchstmöglichen modernen technologischen Standards, sodass eine einheitliche Produktqualität sowohl hinsichtlich einer klar definierten Molekülgröße als auch eines höchsten Reinheitsgrads erzielt werden kann.
hyaDENT BG ist eine biokompatible regenerative Hyaluronsäure höchster Qualität
- 100% frei von tierischen Ausgangsmaterialien für maximalen Infektionsschutz
- Höchstmöglicher Reinheitsgrad für optimale Biokompatibilität
- Klar definierte Molekülgröße als Grundvoraussetzung für gleichbleibende Produktqualität und optimale Performance
hyaDENT BG
Ein hoch konzentriertes Hyaluronsäure-Gel aus einer vernetzten (1,6%) und einer natürlichen HA (0,2%). hyaDENT BG zeichnet sich durch ein langsames Abbauverhalten (mehrere Wochen) aus.
Der Herstellungsprozess für die kreuzvernetzte Komponente in hyaDENT BG wird mit der bewährten BDDE-Methodik durchgeführt. Die Bedingungen für die Vernetzung werden speziell festgelegt, um eine kontrollierte Reaktion zu gewährleisten, die zu einem homogen vernetzten Produkt führt. Darüber hinaus wird die vernetzte HA hochgradig gereinigt, um eine bestmögliche Entfernung des restlichen BDDE zu gewährleisten.
VORTEILE
BESCHLEUNIGTE KONTROLLIERTE WUNDHEILUNG
HA steuert den post-operativen Entzündungsprozess und beschleunigt die Neoangiogenese für eine verbesserte Wundheilung
HA ist am gesamten Prozess der Wundheilung beteiligt und spielt hier eine Vielzahl teils gegensätzlicher Rollen. Sie moduliert die Entzündung und den gesamten Prozess der Wundheilung und behebt Gewebeschäden in Abhängigkeit ihrer Molekülgröße.1-3
Die Anwendung von HA bei Operationswunden oder chronischen Wunden stimuliert die Neoangiogenese nach der Operation.4 Dadurch beschleunigt HA den Heilungsprozess erheblich.4,5
Dies wurde klinisch durch Verkürzung der Zeit zur Epithelneubildung nachgewiesen, z.B. bei Patienten mit Brandverletzungen oder bei der Behandlung von venösen Ulcera.6
Außerdem scheint HA für eine narbenfreie Wundheilung notwendig zu sein. Dies zeigt sich bei der Heilung von fötalen Wunden, welche einen hohen Gehalt an HA im Granulationsgewebe aufweisen. Diese sind dafür bekannt, keine Narben auszubilden.1,2,7
In einem Tierversuch wurde der Einfluss von exogener Hyaluronsäure auf die Heilung von experimentell bei Hamstern hervorgerufenen Wunden untersucht. Die Anwesenheit von exogener HA beschleunigte die frühzeitige Neoangiogenese und die Heilungsdauer wurde maßgeblich von 16 Tagen auf 8,6 ± 0,4 Tagen reduziert.4
Gefäßdichte
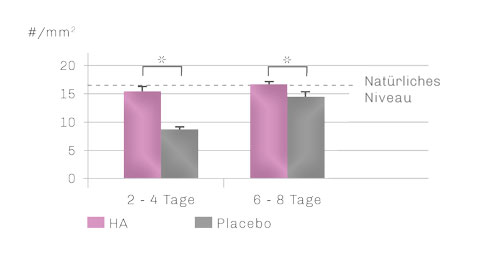
Die zusätzliche Anwendung von HA führt zu einer erhöhten frühzeitigen Angiogenese.
*statistisch signifikanter Unterschied.
Wundverschluss
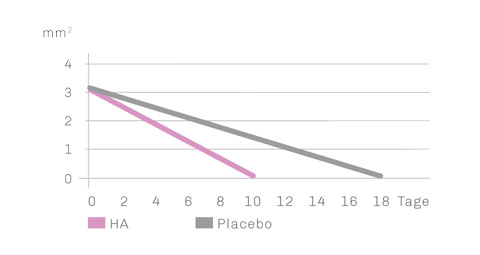
Die zusätzliche Anwendung von HA führt zu einer deutlich beschleunigten Wundheilung.
STABILISIERUNG UND SCHUTZ DES WUNDRAUMS
HA schützt vor Defektkollaps und verhindert Eindringen und Wachstum von potentiellen Krankheitserregern
Die Bildung eines Blutkoagels und dessen Stabilisierung ist essentieller Schritt für eine kontrollierte und ungestörte Wundheilung.
Wenn Hyaluronsäure in den Defekt appliziert wird, bindet sie Flüssigkeiten, interagiert mit Blutbestandteilen (u.a. Fibrinogen) und fördert so die Gerinnung.1 Durch diesen Effekt wird eine verbesserte Stabilisierung des Wundraums bewirkt. Diese Eigenschaft kann insbesondere auch bei der Knochenaugmentation genutzt werden.
Beim Vermischen von partikulärem Knochenersatzmaterial oder autologem Knochen mit HA entsteht eine angenehm zu applizierende und lagestabile Paste („Sticky Bone“).

„Sticky Bone“: pastöse Mischung von partikulärem Knochenersatzmaterial mit hyaDENT BG.
Darüber hinaus besitzt Hyaluronsäure eine ausgeprägte bakteriostatische Wirkung.8,9
Die Anwendung von HA während der chirurgischen Therapie kann die bakterielle Verunreinigung der OP-Wunde verhindern. Dadurch reduziert sich das Risiko einer post-operativen Infektion und eine besser vorhersehbare Regeneration wird gefördert.8
Dies hat auch eine klinische Relevanz. In einem in vivo-Experiment (Beagle-Hunde) wurde der Einfluss von Hyaluronsäure auf die Heilung von chronisch mit dem Parodontalkeim P. Gingivalis infizierten Extraktionsalveolen untersucht.10 Nach 3 Monaten zeigte die Hyaluronsäure-Gruppe eine signifikant bessere Knochenqualität als die Kontrollgruppe (Anteil mineralisiertes Gewebe: 63,3% vs. 47,8%).
Knochenqualität 3 Monate post-OP
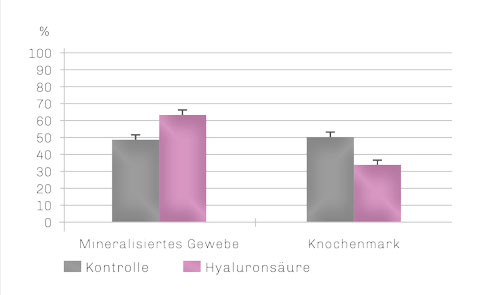
Hyaluronsäure führt zu einer signifikant besseren Knochenqualität in der Ausheilung von chronisch infizierten Extraktionsalveolen.10
UNTERSTÜTZUNG DER GEWEBEREGENERATION
Hyaluronsäure reguliert den Gewebewiederaufbau für ein verbessertes Behandlungsergebnis
Hyaluronsäure spielt eine bedeutende regulierende Rolle bei Aufbau und Regeneration von Weich- und Knochengewebe.7 Sie weist komplexe Wirkungen auf die Weichgewebe- und Knochenzellen in allen Phasen der Heilung in ihren verschiedenen Formen auf.
Aus diesem Grund führt die HA-Applikation bei gängigen chirurgischen oder nicht-chirurgischen Behandlungsprotokollen zu verbesserten klinischen Behandlungsergebnissen, insbesondere bei kritischen Eingriffen. Dies konnte in verschiedenen Studien belegt werden, die auf eine positive Wirkung von HA auf Knochenbildung12-14 und parodontale Regeneration hinweisen.15-20
In einer 2019 publizierten prospektiven Vergleichsstudie wurde der Einfluss von HA auf das Ergebnis einer chirurgischen Rezessionsdeckung der Miller-Klasse I mithilfe einer koronalen Verschiebelappentechnik (CAF) untersucht. Es konnte gezeigt werden, dass die begleitende HA-Anwendung eine vorhersagbare und sichere Methode für die Behandlung einzelner Gingiva-Rezessionsstellen darstellt.
Durch die Anwendung von HA wurden nicht nur die klinischen Ergebnisse verbessert, sondern auch die Patientenmorbidität verringert.21
So konnte in der HA-Gruppe eine statistisch signifikant bessere Abdeckung der Zahnwurzel erzielt werden (93,8 ± 13.0 % i.Vgl. zu 73,1 ± 20,8%).
Gleichermaßen wurden in der HA-Gruppe deutlich mehr Gingiva-Rezessionen komplett gedeckt als in der Kontrollgruppe (80% i. Vgl. zu 33%).
Nach 1 Woche post-OP wiesen mit Hyaluronsäure behandelte Patienten zudem statistisch signifikant weniger Unbehagen und Schwellung auf.
Rezessionsdeckung nach 18 Monaten
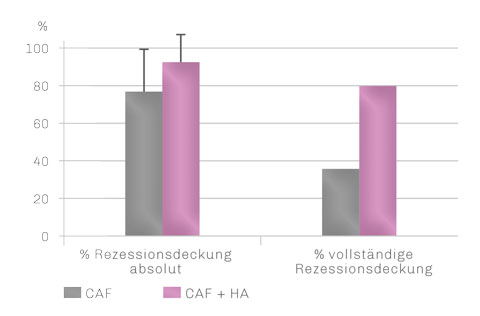
Durch Hyaluronsäure kann mit der CAF-Technik eine signifikant bessere Rezessionsdeckung bei Miller I-Rezessionen erzielt werden.
Der Einfluss von Hyaluronsäure auf die knöcherne Regeneration wurde in einem Tierversuch am Modell der Heilung von Extraktionsalveolen untersucht.12
Die zusätzliche Anwesenheit von HA beschleunigte die frühzeitige Neoangiogenese und führte zu einer deutlich verbesserten Knochenqualität, sowohl im apikalen als auch im zentralen Bereich der Alveole.
Anzahl Blutgefäße
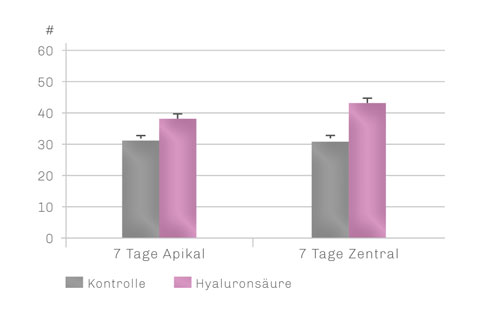
HA-Gruppe zeigt im kompletten Augmentationsbereich eine signifikant höhere Anzahl an Blutgefäßen (7 Tage post-OP) als die Kontrollgruppe.12
Knochendichte
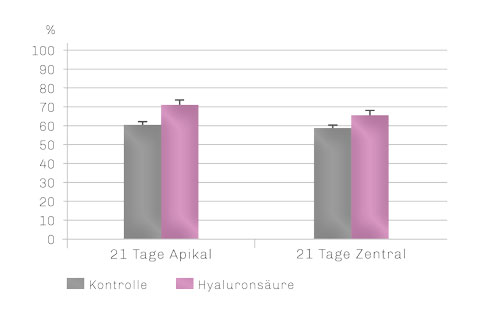
HA-Gruppe zeigt im kompletten Augmentationsbereich eine signifikant höhere Knochendichte (21 Tage post-OP) als die Kontrollgruppe.12
In einer klinischen Vergleichsstudie wurde der Einfluss von HA auf die Knochenqualität und die Volumenstabilität bei externen Sinuslift-Operationen untersucht, die mit synthetischem Tricalciumphosphat (TCP) augmentiert wurden.14
Die Hyaluronsäure-Gruppe zeigte nach 6 Monaten eine signifikant bessere Knochenqualität als die Kontrollgruppe im Sinne eines höheren Anteils an neu gebildetem Knochen und weniger TCP-Restpartikeln. Zudem war der Volumenerhalt des augmentierten Bereichs in der Hyaluronsäure Gruppe signifikant besser als in der TCP-Kontrollgruppe (85,5% vs. 71,4%).
Knochenqualität 6 Monate post-OP
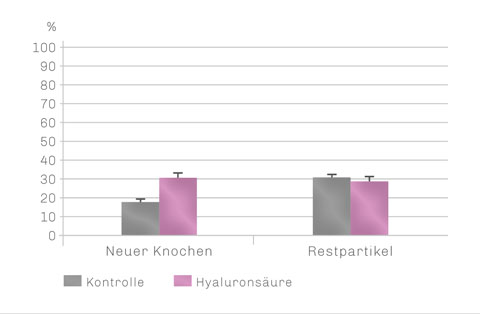
Hyaluronsäure führt zu einer signifikant höheren Knochenneubildungsrate und zu weniger Restpartikeln des Graft-Materials.14
Volumenerhalt 6 Monate post-OP
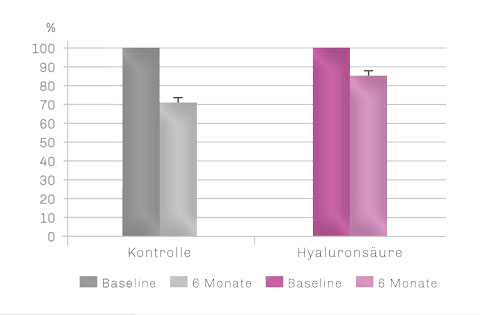
Hyaluronsäure führt zu einem signifikant besserem Volumenerhalt des Augmentats.14
PRODUKTE
| Artikel | Artikelnummer | Darreichung | ||
| hyaDENT BG | 0162.512v2 | 2 Zylinderampullen (2 x 1,2ml) |
INDIKATIONEN
Dieser Bereich wird gerade überarbeitet.
Vielen Dank für Ihr Verständnis.
KLINISCHE EVIDENZ
TECHNOLOGIE
Hyaluronsäure-Herstellung
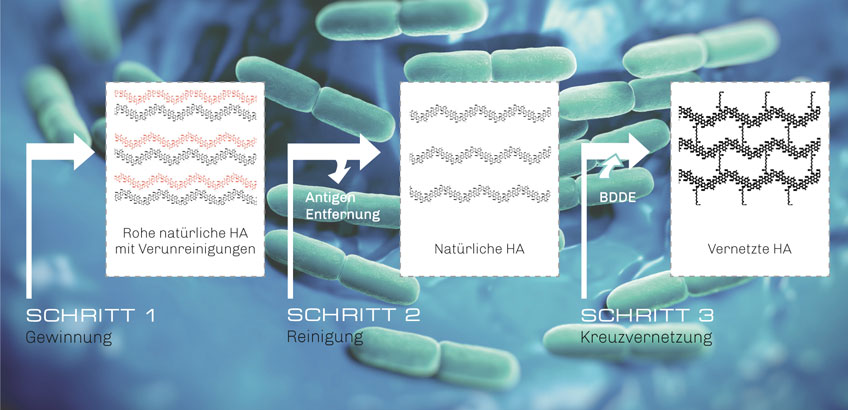
1. Gewinnung
Reine Hyaluronsäure ist bei allen Spezies gleich,1 was die Gewinnung für die exogene Anwendung erleichtert. Traditionell wird HA aus Hahnenkämmen und der Augenflüssigkeit von Rindern extrahiert. HA bildet allerdings einen Komplex mit anderen Makromolekülen, sodass die Isolation einer bestimmten HA-Qualität aus diesen Quellen schwierig zu bewerkstelligen ist.
Infolgedessen weist die HA tierischer Herkunft eine variierende Zusammensetzung auf.22
Zudem wird der Verwendung von tierischen Substanzen für die Behandlung beim Menschen wachsender Widerstand aufgrund ethischer Argumente und möglichem Risiko einer Virus-Infektion entgegengebracht. Moderne Technologien, HA zu gewinnen, basieren auf der Anwendung eines bakteriellen Fermentationsprozesses ohne die Verwendung tierischer Gewebe.23
Bei der biotechnologisch hergestellten HA können die polymeren Eigenschaften sehr genau kontrolliert werden. Dies ermöglicht eine homogene HA-Zusammensetzung auf sichere und umweltfreundliche Art.
2. Reinigung
Die sorgfältige Aufreinigung der so gewonnenen Hyaluronsäure spielt eine entscheidende Rolle dabei, zurückgebliebene bakterielle Proteine zu entfernen. Letztere können antigene Eigenschaften aufweisen und so eine Empfängerreaktion hervorrufen.24
3. Kreuzvernetzung
Während natürliche HA-Komponenten im Allgemeinen einem schnellen Abbau unterliegen, benötigen viele erfolgreiche Therapieverfahren eine längere Verweildauer im Körper. Um das Resorptionsprofil der HA-Derivate zu verlängern, wird natürliche HA mittels bewährter chemischer Technologien vernetzt. Der Grad der Vernetzung beeinflusst sowohl die Abbauzeit als auch die physiologische Wirksamkeit.
Die etablierteste Methode ist die Anwendung von BDDE (Butandiol-diglycidylether) als Vernetzungs-Agens.
Die Kehrseite der Verwendung von BDDE besteht darin, dass Rückstände im HA-Implantat Nebenwirkungen hervorrufen können. Daher ist die sorgfältige Reinigung von vernetzter HA elementar.25
LITERATUR
- Kessiena L et al. Wound Rep Reg 2014;22:579-593.
- Longaker T et al. Ann. Surg. 1991;4:292–296.
- Mast BA et al. Matrix 1993;13:441–446.
- King SR et al. Surgery 1991;109(1):76-84.
- Ortonne JP. Ann Dermatol Venereol 2001;Mar(Suppl.):13–16.
- Ruggiero SL et al. J Dent Res 1987;66:1283-1287.
- Salbach J et al. J Mol Med 2012;90:625–635.
- Pirnazar P. et al. Journal of Periodontology 1999;70:370-374.
- Carlson GA et al. Biochem Biophys Res Comm 2004;321:472–478.
- Kim JJ et al. J Periodontol. 2016;87(7):790-795.
- Lee JY, Spicer AP. Curr Opin Cell Biol 2000;12:581–586.
- Mendes RM et al. Arch Oral Biol 2008;53:1155–1162.
- Muzaffer A et al. J Biomat Appl 2006;20:209-220.
- Stiller M. et al. Biomaterials 2014;35(10):3154-3163.
- Bevilacqua, L. et al. Annali di Stomatologia (Roma) 2012;3:75-81.
- Johannsen A. et al. J Periodontol 2009;80:1493-1497.
- Pilloni A. et al. J Appl Biomat & Biomech 2003;1:84-90.
- Chauhan AS et al. Contemporary Clinical Dentistry 2013;4:54–61.
- Briguglio, F. et al. Quintessence Int 2013;44:231-240.
- Fawzy ES et al. Clin Oral Invest 2012;16:1229–1236.
- Pilloni A et al. Clin Oral Investig. 2019 Mar;23(3):1133-1141. Erratum in: Clin Oral Investig. 2018;22(8):2961-2962.
- Kitchen JR et al. Biochem J 1995;309:649–656.
- Saranraj P and Naidu MA. IJPBA, 2013;4(5):853–859.
- André, P. J Europ Acad Dermatol Venereol 2004;18:422–425.
- De Boulle K et al. Dermatologic Surgery 2013;39(12):1758-1766.
DOWNLOAD-BEREICH
OSSIX™ BONE
Zucker-kreuzvernetzter Kollagenschwamm zur GBR

OSSIX™ Bone ist ein neuer mineralisierter Kollagenschwamm aus hochreinen porcinen Kollagenfasern (Typ I). Durch die Herstellung mit der patentierten GLYMATRIX®-Technologie (Vernetzung mit natürlichen Zuckern) wird eine hochporöse 3D-Matrix aus einem Kollagenfasernetzwerk erhalten, in das gleichmäßig synthetisches kristallines Hyadroxylapatit eingebettet ist.
Aufgrund der einzigartigen Kombination aus langsam resorbierendem, vernetztem Kollagen, resorbierbarem Hydroxylapatit und der schwammartigen Struktur, stellt OSSIX™ Bone ein optimales Gerüst für die Knochenregeneration dar.
Der vernetzte Kollagenschwamm zeigt ein echtes Remodeling in vitalen Knochen ohne Reste von avitalen Graftpartikeln.
Aufgrund der außergewöhnlichen Stabilität von GLYMATRIX®-vernetztem Kollagen gegen bakterielle Enzyme ermöglicht OSSIX™ Bone in vielen Situationen ein vereinfachtes Protokoll für die Socket Preservation, ohne die Notwendigkeit aufwendiger Lappentechniken und ohne zusätzliche Verwendung einer Barrieremembran.

Struktur des OSSIX™ Bone-Kompositgrafts (Rasterelektronenmikroskop): Schwammartige Matrix aus organisierten Kollagenfasern für optimale osteokonduktive Eigenschaften (Mi, Vergrößerung x 200), im vernetzten Kollagennetzwerk eingebettete Mineralkristalle (re, Vergrößerung x 1.000).
VORTEILE
ZUVERLÄSSIGE MATRIXFUNKTION
Spongiöse mineralisierte Kollagenmatrix ermöglicht schnelle Gewebeintegration und kontrollierten Umbau in neuen vitalen Knochen.
Durch den GLYMATRIX®-Prozess erhält OSSIX™ Bone (OB) seine biokompatible, kreuzvernetzte Kollagenstruktur. Der spongiöse und trabekuläre Aufbau, sowie die natürliche Porosität von OB bieten eine ideale Leitschiene für die schnelle Revaskularisierung und den Umbau des Kollagenschwamms in gesunden und funktionellen Knochen.1 Das hochreine Matrixkollagen fördert die Zelladhäsion, die Ablagerung von Mineralien und die Knochenbildung.2 Die Abbildung verdeutlicht die rasche Vaskularisierung von OB in vivo1 und die guten Gerüsteigenschaften für die Zelladhäsion3.

Signifikante Vaskularisierung von OSSIX™ Bone nach 2 Wochen (subkutane Implantation in Mäusen, li). Ausgezeichnete Zelladhäsionseigenschaften des Matrixkollagens in der Mitte des Kollagenschwamms (Chondroblasten, in vitro-Studie, re).
Aufgrund der langsamen Resorption und des osteokonduktiven Profils des vernetzten Kollagens ossifiziert OSSIXTM Bone nach Implantation und dient als volumenstabiles Gerüst für die Bildung von neuem Knochengewebe.1,4
In einer vergleichenden in vivo-Studie (Beagle-Hunde) wurden große Alveolardefekte entweder mit einem Komposit-Block aus deproteinisiertem bovinen Knochenmineral und Kollagen (DBBMC) oder mit OSSIX™ Bone gefüllt und mit der OSSIX® Plus-Membran (OP) abgedeckt.1
Die OB-Gruppe zeigte im Vergleich zur DBBMC-Gruppe eine signifikant bessere Wiederherstellung des Kieferkamms, eine signifikant größere Wiederherstellung der Kammbreite sowie echte natürliche Knochenneubildung ohne Reste des Graft-Materials.
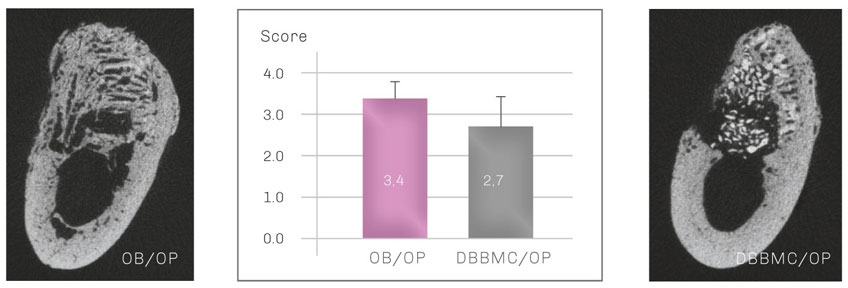
Nach 6 Monaten zeigt OB ausgezeichnete Graftinkorporation und Kammerhalt (Mikro-CT, li). Im Gegenteil dazu sind DBBMC-Partikel immer noch sichtbar und weniger knöchern integriert (Mikro-CT, re).
OB zeigt im Vergleich zu DBBMC eine signifikant bessere Wiederherstellung des Kieferkamms (Mi).
ECHTE KNOCHENREGENERATION*
Langsam resorbierende Kollagenstruktur für volumenstabiles Remodeling in vitalen Knochen ohne Rückstände von Graftpartikeln
Durch den physiologischen GLYMATRIX®-Vernetzungsprozess besitzt die Kollagenkomponente von OSSIX™ Bone ein langsames und kontrolliertes biologisches Abbauprofil.1,4
Es ist bekannt, dass Zucker-vernetztes Kollagen durch Ossifikation umgebaut und allmählich in mineralisiertes Gewebe eingebettet wird. Daher fungiert es als osteokonduktives Gerüst zur Geweberegeneration.5
Aufgrund seiner strukturellen Eigenschaften (poröser Kompositschwamm aus Faserkollagen und kristallinem HA) weist OB vergleichbare Materialparameter auf wie natürlicher humaner Knochen6.
Daher verfügt OB über alle Voraussetzungen für ein kontrolliertes Remodeling in vitalen Knochen, wie es für autologe Transplantate und teilweise auch für mineralisierte Allografts bekannt ist.7,8
Dies ist ein erheblicher Vorteil gegenüber anderen Komposit-Grafts, die typischerweise aus schnell resorbierendem Kollagen und langsam- bzw. nicht resorbierbarem Material bestehen, gewöhnlich aus boviner Herkunft (DBBMC).
So zeigen große Alveolardefekte bei Hunden 6 Monate nach Augmentation mit OB histologisch eine gleichmäßige Defektfüllung mit hohen Mengen an neu gebildetem Knochen und keine nachweisbaren Graft-Reste.
Im Gegensatz dazu werden mit DBBMC augmentierte Defekte nicht gleichmäßig mit neuem Knochen gefüllt. Es können signifikante Reste von bovinen Graftpartikeln gefunden werden, die nur teilweise mit neuem Knochen in Kontakt stehen.
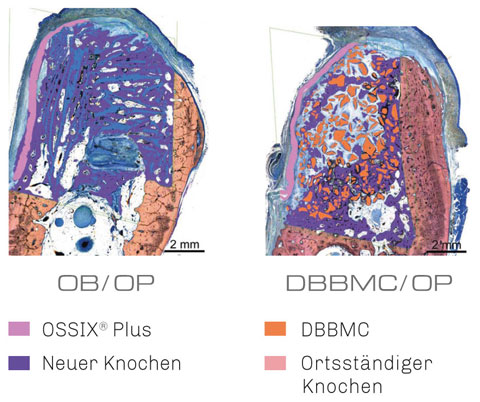
Histologische Auswertung 6 Monate nach Augmentation großer alveolärer Knochendefekte in Hunden: OSSIX™ Bone-Gruppe zeigt eine gleichmäßige Defektfüllung mit hohem Anteil an neu gebildetem Knochen, keine sichtbaren Graft-Reste (li). DBBMC-Gruppe weist signifikante Reste von DBBM-Partikeln auf, die nicht gleichmäßig von neuem Knochen umgeben sind (re).
Eine histomorphometrische Analyse bestätigt den histologischen Befund und damit das unterschiedliche Umbauprofil von OB und DBBMC.1
Bei allen untersuchten Zeitintervallen nach Augmentation weist die OB-Gruppe eine höhere Menge an neu gebildetem Knochen auf als die DBBMC-Gruppe. Darüber hinaus wurde bei OB im Gegensatz zu DBBMC keine Migration der Graft-Partikel beobachtet.
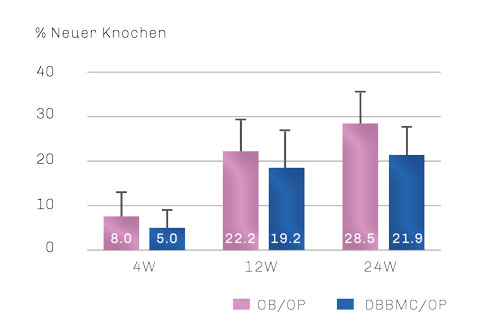
Histomorphometrische Analyse von neu gebildetem Knochen: OSSIX™ Bone-Gruppe zeigt bei allen Zeitintervallen eine höhere Menge an neu gebildetem Knochen als die DBBMC-Gruppe (P<0.05).
* falls keine Lappenmobilisation durchgeführt wird
VEREINFACHTES CHIRURGISCHES PROTOKOLL
Kollagene Schwammstruktur ermöglicht vereinfachte Applikation ohne Partikelmigration
OSSIX™ Bone zeichnet sich durch eine schwammartige Struktur aus.
Daher wird das Augmentationsprotokoll im Vergleich zu partikulärem Graftmaterial erleichtert, da der OB-Schwamm leicht an die Defektgeometrie angepasst und so die Partikelmigration vermieden werden kann.
Aufgrund der ausgeprägten Resistenz von mit GLYMATRIX® vernetztem Kollagen gegen bakterielle Enzyme9 ermöglicht OSSIX™ Bone in vielen Situationen ein vereinfachtes Protokoll für die Socket Preservation, ohne aufwendige Lappenpräparation und ohne zusätzlichen Einsatz einer Barrieremembran.
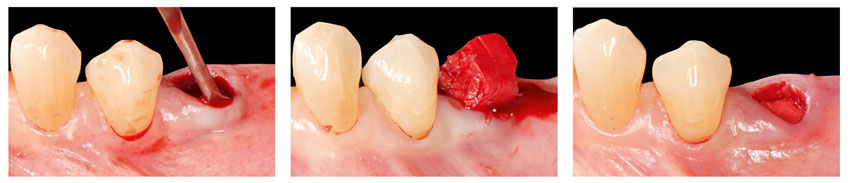
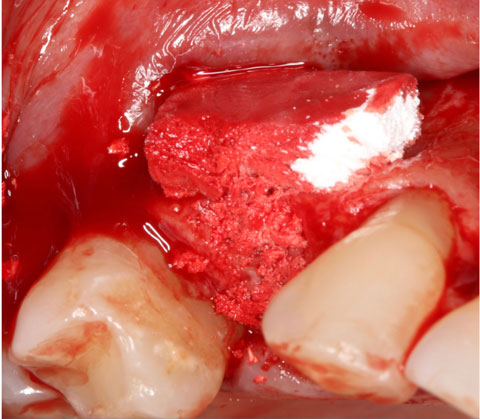
Applikation von OSSIX™ Bone in eine Extraktionsalveole ohne Lappenpräparation: Nach der Zahnextraktion (li) wird OB mit Defektblut getränkt (Mi) und vorsichtig bis zum krestalen Level in die Alveole eingebracht (re). Mit freundlicher Genehmigung von Dr. Fred Silva, USA.
PRODUKTE

| Artikelnummer | Größe | |
| 0155.310 | 5 x 5 x 5mm | |
| 0155.311 | 5 x 5 x 10mm | |
| 0155.312 | 5 x 10 x 10mm |
INDIKATIONEN
OSSIX™ Bone – vereinfachte Applikation für echte Knochenneubildung

OSSIX™ Bone kann bei folgenden Indikationen verwendet werden:
| INDIKATION |
OSSIX™ Bone |
OSSIX™ Bone + Membran |
||
| Socket Preservation mit intakter Knochenlamelle |  |
|||
| Socket Preservation mit defizitärer Knochenlamelle |  |
 |
||
| Geschlossener / Transkrestaler Sinuslift |  |
 |
||
| Augmentation von periimplantären Defekten |  |
|||
| Laterale Augmentation (GBR) |  |
*falls keine Lappenmobilisation durchgeführt wird
Lesen Sie vor Gebrauch die Gebrauchsanweisung, Informationen zu Indikationen, Kontraindikationen, Warnungen und Vorsichtsmaßnahmen.
KLINISCHE EVIDENZ
TECHNOLOGIE
Kollagen / Mineral-Komposite
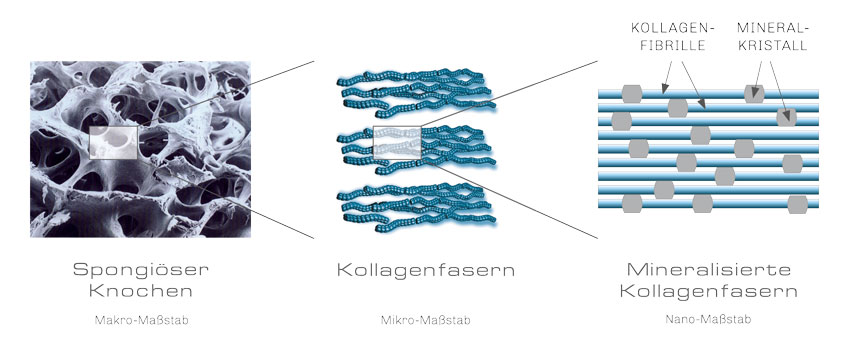
Zusammensetzung der natürlichen Knochenmatrix: Mineralisiertes Kollagen stellt den elementaren Baustein des natürlichen Knochens dar.
Knochen ist ein dynamisches biologisches Gewebe und besteht aus metabolisch aktiven Zellen, die in ein rigides Gerüst integriert sind.
Die Hauptkomponenten der menschlichen Knochenmatrix sind natürliches Hydroxylapatit und Kollagen Typ I.10
DBBMC ist das bekannteste Kollagen / Mineral-Kompositgraft und wird durch „Verkleben“ von losen DBBM-Partikeln mit Kollagen hergestellt.
Es weist eine unorganisierte Struktur auf, bei der die großen bovinen Knochenpartikel zufällig zwischen den Kollagenfasern dispergiert sind.
OSSIX™ Bone basiert dagegen auf strukturierten Zucker-vernetzten Kollagenfasern, die mit HA mineralisiert werden.
Dieses Verfahren wurde ursprünglich zur Entwicklung von GBR-Membranen und Matrices (OSSIX® Plus / Volumax) angewendet, die ein deutlich verlängertes Resorptionsmuster im Vergleich zu nativen Kollagenmaterialien aufweisen.
Aufgrund des langsamen Abbauprofils können diese Materialien als osteokonduktives Gerüst wirken, das neues Knochenwachstum unterstützt.
Der Matrixkörper des vernetzten Kollagens wird in den ortsständigen Knochen integriert (Membran-Ossifikation)4,5,11 und im Laufe der Zeit durch einen zellulären Prozess zu neuem vitalen Knochen umgebaut5.
Durch diese Technologie kann ein hochorganisierter poröser Knochenschwamm hergestellt werden. Kleine synthetische Hydroxylapatit-Partikel sind statistisch gleichmäßig im honigwabenartigen dreidimenionalen Kollagengerüst verteilt.
Die Knochenneubildung wird meist durch knochenbildende Zellen (Osteoblasten) ausgelöst. Diese bilden initial Osteoid, ein kollagenreiches nichtmineralisiertes Gewebe. Beim anschließenden Knochenumbau wird die Kollagenfibrille im Osteoid durch HA-Kristalle mineralisiert, die in das Kollagengerüst eingebettet werden.12
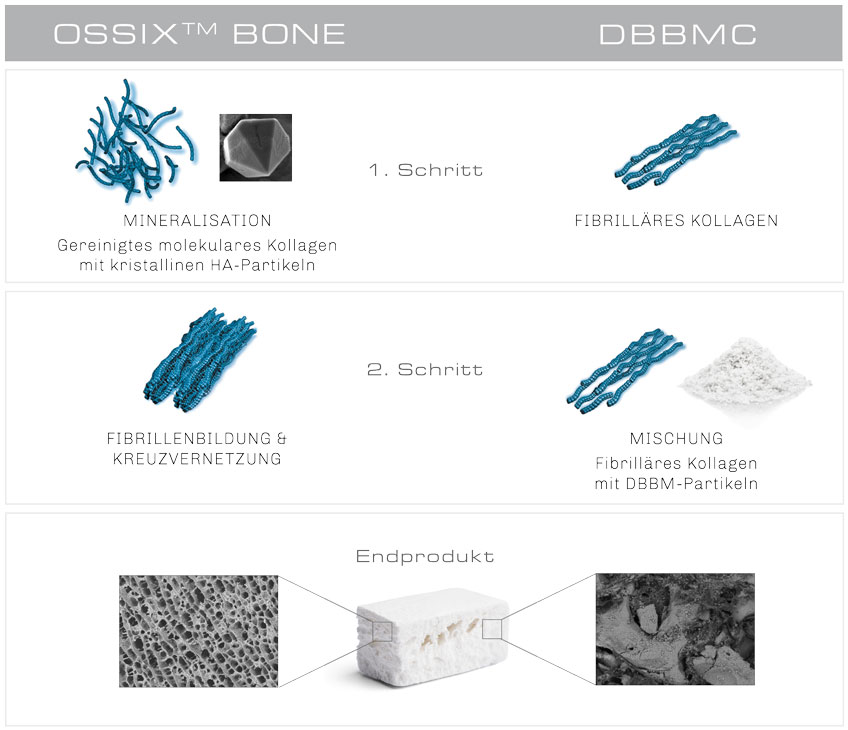
Herstellungsschritte und Strukturvergleich von OSSIX™ Bone vs. DBBMC (Rasterelektronenmikroskop, Vergrößerung x 200). OB ist hoch organisiert mit einer schwammartigen Struktur, DBBMC besteht hauptsächlich aus voluminösen DBBM-Partikeln in einem losen Kollagennetzwerk.
LITERATUR
- Zubery Y, Goldlust A, Bayer T, Woods S, Jackson N, Soskolne WA. Alveolar Ridge Restoration Using a New Sugar Cross-linked Collagen-Hydroxyapatite Matrix in Canine L-shape Defects. AO 2017:P204.
- Brett D. A Review of Collagen and Collagen-based Wound Dressings. Wounds 2008;20(12).
- Interne Testergebnisse.
- Zubery Y, Nir E, Goldlust A. Ossification of a collagen membrane cross-linked by sugar: a human case series. J Periodontol. 2008;79(6):1101-1107.
- Zubery Y, Goldlust A, Bayer T, Woods S, Jackson N, Soskolne WA. AAP 2016:P125.
- Bandyopadhyay-Ghosh S. Bone as a Collagen-hydroxyapatite Composite and its Repair. Trends Biomater Artif Organs 2008;22(2):116-12S4.
- Schmitt CM, Doering H, Schmidt T, Lutz R, Neukam FW, Schlegel KA. Histological results after maxillary sinus augmentation with Straumann® BoneCeramic, Bio-Oss®, Puros®, and autologous bone. A randomized controlled clinical trial. Clin. Oral Impl. Res. 00, 2012, 1–10 doi: 10.1111/j.1600-0501.2012.02431.x
- Wang H-L, Tsao Y-P. Histologic Evaluation of Socket Augmentation with Mineralized Human Allograft. Int J Periodontics Restorative Dent 2008, 28:231-237.
- Klinger A, Asad R, Shapira L, Zubery Y. In vivo degradation of collagen barrier membranes exposed to the oral cavity. Clin. Oral Impl. Res. 2010;21:873–876.
- Singh AB, Majumdar S. The Composite of Hydroxyapatite with Collagen as a Bone Grafting Material. J Adv Med Dent Scie Res 2014;2(4):53-55.
- Zubery Y, Goldlust A, Alves A, Nir E. Ossification of a novel cross-linked porcine collagen barrier in guided bone regeneration in dogs. J Periodontol. 2007;78(1):112-121.
- Baron R. Anatomy and Ultrastructure of Bone – Histogenesis, Growth and Remodeling. [Updated 2008 May 13]. In: Feingold KR, Anawalt B, Boyce A, et al., editors.