BIOLOGISIERUNG
Hyaluronsäure optimiert Ihren Behandlungserfolg
Hyaluronsäure-Derivate (HA) sind heute "sprichwörtlich" in aller Munde.
HA, eine physiologische Substanz, stellt eine der Hauptkomponenten der außerzellulären Matrix des Bindegewebes, der Gelenkflüssigkeit und vieler anderer Gewebe dar.1-3
Zahlreiche Studien zeigen, daß Hyaluronsäure eine ideale Biokomponenente für kosmetische, medizinische und pharmazeutische Anwendungen ist.4-6
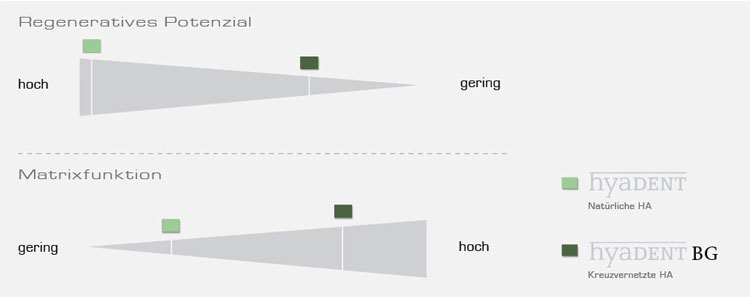
Je nach Indikation und angestrebter Funktion wird HA entweder in natürlicher Form oder mit zusätzlicher Kreuzvernetzung verwendet.
Natürliche HA weist das höchste regenerative Potenzial auf. Sie wird innerhalb von wenigen Stunden bis zu einigen Tagen in vivo abgebaut.
Vernetzte HA wird aus natürlicher HA mittels bewährter Technologien hergestellt. Mit zunehmender Vernetzungsrate kann das Abbauverhalten auf bis zu mehrere Monate verlängert werden.
Die hyaDENT Produktfamilie stellt eine Behandlungslösung aus Hyaluronsäure dar, die auf regenerative dentale und parodontale Anwendungen abgestimmt wurde. Mit hyaDENT und hyaDENT BG sind 2 Präparate mir einem unterschiedlichen Vernetzungsgrad verfügbar, die aufgrund ihrer physiologischen Eigenschaften für verschiedene regenerative Indikationsstellungen eingesetzt werden können.
LITERATUR
- Lee JY, Spicer AP. Hyaluronan: a multifunctional, megadalton, stealth molecule. Curr Opin Cell Biol 2000;12:581–586.
- McDonald J, Hascall VC. Hyaluronan mini review series. JBiol Chem 2002;277:4575–4579.
- Jiang D et al. Hyaluronan as an immune regulator in human diseases. Physiol Rev 2011;91:221–264.
- Kessiena L et al. Hyaluronan in wound healing: Rediscovering a major player. Wound Rep Reg 2014;22:579-593.
- Saranraj P and Naidu MA. Hyaluronic Acid Production and its Applications - A Review. IJPBA, 2013; 4(5):853–859.
- King SR, Hickerson WL, Proctor KG. Beneficial actions of exogenous hyaluronic acid on healing. Surgery. 1991;109(1):76-84.
KNOCHENAUFBAU
Volumenstabilität mit langsam resorbierenden KEM vs. Beschleunigte Regeneration mit schnell resorbierenden KEM
Die Leistungsfähigkeit von Knochenersatzmaterialien (KEM) wird vor allem durch deren Leitschienenfunktion für einen knöchernen Durchbau bestimmt (Osteokonduktivität).1 Materialien mit einer großen ultrarauen Oberfläche und einer hohen interkonnektierenden Porosität fördern das Zellattachment besonders und wirken demzufolge stark osteokonduktiv.2
Herkunft, Zusammensetzung und physikochemische Eigenschaften von KEM nehmen nicht nur Einfluss auf die Osteokonduktivität, sondern ebenfalls auch auf die klinische Leistungsfähigkeit.
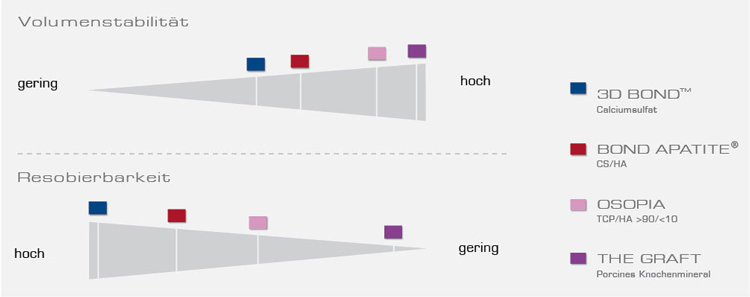
Allgemein gilt: KEM mit einem schnellen Resorptionsprofil ermöglichen eine beschleunigte Knochenneubildung und somit auch eine zeitigere Weiterversorgung des Patienten als Materialien mit einem langsamen Resorptionsprofil.3
Auf der anderen Seite ist bekannt, dass mit langsam resorbierendem KEM ein verbesserter Volumenerhalt als mit schnell resorbierenden Materialien, wie z.B. autologem Knochen, erzielt werden kann.4
Die Auswahl ob schnell resorbierend oder volumenstabil hängt v.a. von der individuellen Defektsituation und dem jeweiligen Therapieziel ab.
Um den verschiedensten Indikationen optimal gerecht zu werden, beinhaltet das REGEDENT KEM-Portfolio Präparate mit unterschiedlichem Resorptionsprofil. Ursprung und Herstellungsprozess der Materialien wurden sorgfältig gewählt, um eine ideale Gewichtung beider Faktoren und somit eine best- und schnellstmögliche knöcherne Integration zu ermöglichen:
LITERATUR
- Kolk A, Handschel J, Drescher W, Rothamel D, Kloss F, Blessmann M, Heiland M, Wolff K-D, Smeets R, Current Trends and future perspectives of bone substitute materials – From space holders to innovative biomaterials. J CMF Surg 2012;40:705-718.
- Dorozhkin SV. Medical Application of Calcium Orthophosphate Bioceramics. BIO 2011;1:1-51.
- Schmitt CM, Doering H, Schmidt T, Lutz R, Neukam FW, Schlegel KA. Histological results after maxillary sinus augmentation with Straumann® BoneCeramic, Bio-Oss®, Puros®, and autologous bone. A randomized controlled clinical trial. Clin. Oral Impl. Res. 00, 2012, 1–10 doi: 10.1111/j.1600-0501.2012.02431.x
- Jensen T, Schou S, Svendsen PA, Forman JL, Gundersen HJ, Terheyden H, Holmstrup P 2012. Volumetric changes of the graft after maxillary sinus floor augmentation with Bio-Oss and autogenous bone in different ratios: a radiographic study in minipigs. Clin Oral Implants Res. 23(8):902-10.
MEMBRANTECHNOLOGIEN
Lange Barrierefunktion vs. schnelle Gewebeintegration
Das Prinzip der gesteuerten Knochenregeneration (GBR) beruht auf der Isolation der für die Knochenregeneration notwendigen regenerativen Zelltypen von schnell proliferierenden Epithel- und Bindegewebszellen mit Hilfe einer mechanischen Barrieremembran.1,2
Resorbierbare Membranen aus tierischem Kollagen sind heute der GBR-Behandlungsstandard.3 Die Geschwindigkeit der Biodegradation und die davon abhängige Dauer der Barrierefunktion von Kollagenmembranen hängt vom natürlichen Vernetzungsgrad der Kollagenfasern ab.4
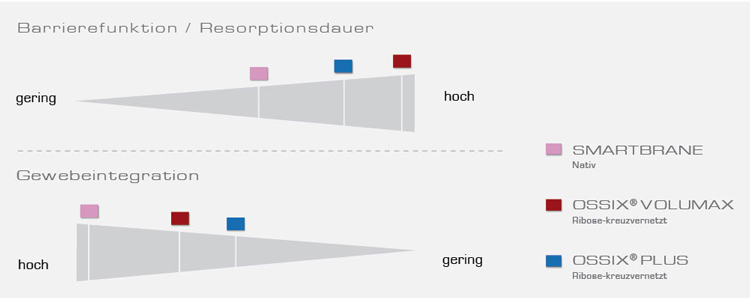
Native Kollagenmembranen werden durch Aufreinigung von tierischem Gewebe wie z.B. Peritoneum oder Perikard gewonnen. Sie sind im Allgemeinen hoch bioverträglich und werden sehr schnell in die umliegenden Gewebe integriert.4 Durch den herkunftsbedingten begrenzten Vernetzungsgrad ist ihre Barrierefunktion allerdings limitiert, was das Potential der knöchernen Regeneration einschränkt, besonders bei anspruchsvollen GBR-Indikationen.5,6
Durch physikalische bzw. chemische Techniken kann der Vernetzungsgrad von nativem Kollagen erhöht werden, wodurch eine Verlängerung der Resorptionszeit erzielt werden kann.4 Dies führt zwar zu einer langsameren Gewebeintegration dieser Membranen, allerdings ist das knöcherne Regenerationspotential deutlich höher als bei nativen Kollagenmembranen.7
Mit der nativen SMARTBRANE und der Familie der Ribose-vernetzten OSSIX®-Membranen (OSSIX® Plus und OSSIX® Volumax) stehen ihnen moderne hoch biokompatible porcine Kollagenmembranen mit einem unterschiedlichen Barriereprofil zur Verfügung.
LITERATUR
- Dahlin C, Linde A, Gottlow J, Nyman S: Healing of bone defects by guided tissue regeneration. Plast Reconstr Surg 1988;81:672–676
- Gottlow J, Nyman S, Karring T, Lindhe J: New attachment formation as the result of controlled tissue regeneration. J Clin Periodontol 1984;11:494–503.
- Bunyaratavej P, Wang H L: Collagen membranes: a review. J Periodontol 2001;72: 215–229.
- Rothamel D, Schwarz F, Sager M, Herten M, Sculean A, Becker J. Biodegradation of differently cross-linked collagen membranes. An experimental study in the rat. Clin Oral Implants Res 2005;16:369–378.
- Oh TJ, Meraw SJ, Lee EJ, Giannobile WV, Wang HL: Comparative analysis of collagen membranes for the treatment of implant dehiscence defects. Clin Oral Implants Res 2003;14:80–90.
- Owens KW, Yukna RA: Collagen membrane resorption in dogs: a comparative study. Implant Dent 2001;10:49–58.
- Goissis G, Marcantonio E Jr., Marcantonio RA, Lia RC, Cancian DC, De Carvalho WM. Biocompatibility studies of anionic collagen membranes with different degree of glutaraldehyde cross-linking. Biomaterials 1999;20:27-34.