Knochenaugementation/GBR
Verbesserte Knochenheilung mit xHyA
Die gesteuerte Knochenregeneration (GBR) ist die am besten dokumentierte Methode zur Augmentation von Knochen bei lokalisierten Alveolarkammdefekten.1
Wesentliche kritische Parameter sind u.a. die Stabilisierung des Wundraums und ein umgehender, ungestörter Gefäßanschluss des Augmentats.
Wundheilungsstörungen stellen häufige Komplikationen dar, z.B. nach einer Weichteildehiszenz.2-4
Aufgrund der benachteiligten mechanischen Lagestabilität der Knochenpartikel kann es zu einem Kollaps des augmentierten Defektvolumens kommen.5-9 Durch Mischung von Knochenpartikeln mit Hyaluronsäure können die Lagestabilität verbessert sowie Heilungsprozesse beschleunigt werden.
BEHANDLUNG
Mit xHyA steht Ihnen eine Hyaluronsäure (HA) zur Verfügung, die für den Einsatz in der regenerativen Zahnmedizin entwickelt wurde.
HA weist eine Reihe von physiologischen Wirkungen auf, die zur Unterstützung der Regeneration von parodontalen und oralen Wunden entscheidend sind, sowohl bei geschlossener als auch bei chirurgischer Anwendung.
- Stabilisierung und Schutz des Wundraums6-11
- Unterstützung der Geweberegeneration9,12-19
- Beschleunigte kontrollierte Wundheilung8,9,20-23
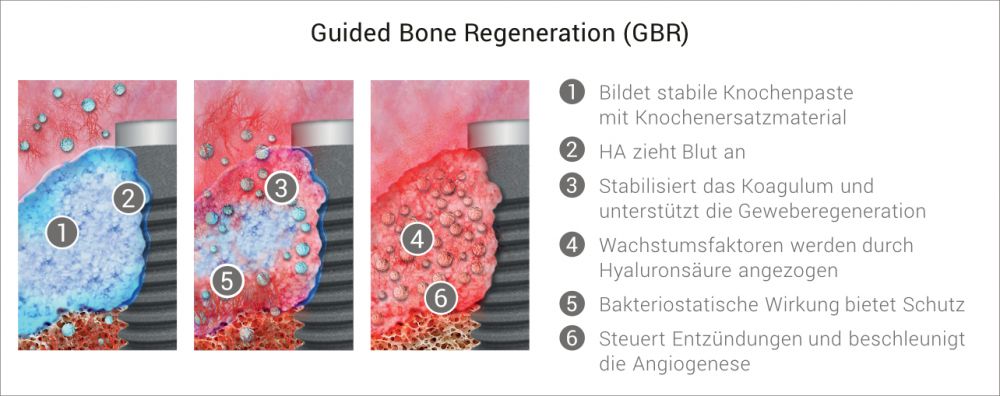
Moderne vernetzte Hyaluronsäure als Alternative zur Zentrifuge
Blutkonzentrate werden heute in der modernen Oralchirurgie stark thematisiert. Sie verbessern das intraoperative Handling von partikulärem KEM („Sticky Bone“) und zeigen positive Effekte auf die Wundheilung.
Häufig unterschätzt wird der einhergehende finanzielle und operative Aufwand vor Inbetriebnahme, beginnend mit Anschaffung eines zusätzlichen Gerätes, räumlicher Bereitstellung, Schulung der einzelnen Mitarbeiter und Integration in den Behandlungsablauf.
Ist Hyaluronsäure eine Alternative?
Aktuellste Publikationen bestätigen die Verbesserung zahlreicher Faktoren bei der Verwendung von Hyaluronsäure in der Knochenregeneration. Das alles in mit einem völlig vereinfachtem Anwendungsprozess ohne Investition.

VORTEILE
- Beschleunigte Knochenheilung
- Höhere Volumenstabilität des Augmentats
- Verlängerung des Membran-Abbauprofils
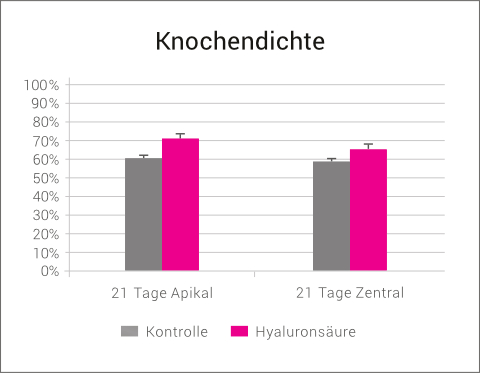
Der Einfluss von Hyaluronsäure auf die knöcherne Regeneration wurde in einem Tierversuch am Modell der Heilung von Extraktionsalveolen untersucht.24
Die zusätzliche Anwesenheit von HA beschleunigte die frühzeitige Neoangiogenese und führte zu einer deutlich verbesserten Knochenqualität, sowohl im apikalen als auch im zentralen Bereich der Alveole.
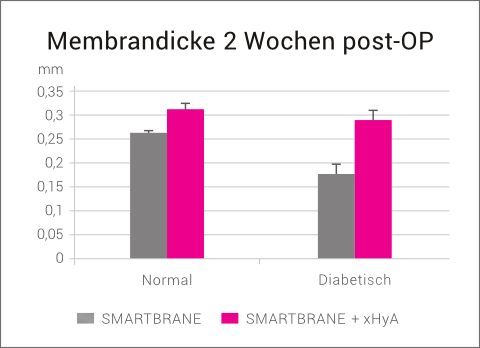
Darüber hinaus verlängert vernetzte Hyaluronsäure das Abbauprofil von Kollagenmembranen. In einer Tierstudie mit gesunden und diabetischen Ratten wurden native Kollagenmembranen (SMARTBRANE) in eine subkutane Tasche implantiert und der Einfluss von xHyA auf den Resorptionsgrad der Membranen nach 2 Wochen post-OP untersucht. Die vorherige Behandlung mit xHyA führte zu einer signifikanten Verringerung des Abbauprozesses, insbesondere bei den diabetischen Ratten, vermutlich aufgrund der xHyA-induzierten Herabregulierung der Makrophagenaktivität.25
Aufgrund der oben beschriebenen positiven Eigenschaften von xHyA können signifikant verbesserte Ergebnisse bei Augmentationen erzielt werden.
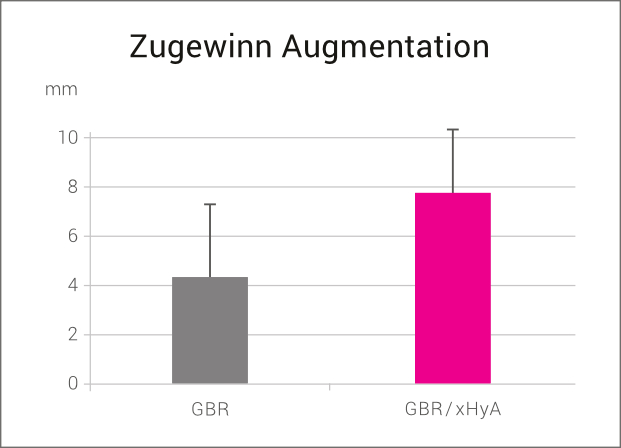
Dies konnte in einer klinischen Vergleichsstudie gezeigt werden. Die Patienten mit ausgeprägten horizontalen Kieferkammdefekten wurden mit einem klassischen GBR-Ansatz (Kombination eines langsam resorbierenden bovinen Knochenersatzmaterial und einer nativen Kollagenmembran) behandelt. In der Testgruppe wurde vor der Augmentation sowohl das Knochenersatzmaterial als auch die Membran mit xHyA vermischt. Nach 6 Monaten konnte in der xHyA-Gruppe ein signifikant höherer Zugewinn an Kieferkammbreite verzeichnet werden (7,7mm vs. 4,4mm).26
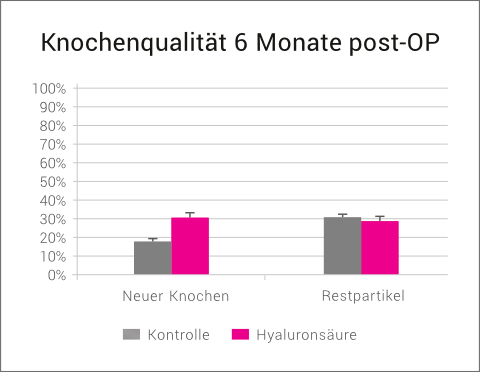
Eine histologische Begutachtung der Knochenqualität nach 6 Monaten zeigte in der xHyA-Gruppe eine deutlich verbesserte Knochenqualität im Sinne von mehr neu gebildetem Knochen und weniger avitalen Restpartikeln.
Diese Beobachtung wurde auch in einem Split- Mouth Case erhalten, in dem Extraktionsalveolen entweder mit einem langsam resorbierbaren Knochenersatzmaterial (DBBM) alleine oder mit einer Kombination aus DBBM/xHyA aufgefüllt wurden.
Nach 3 Monaten waren in der xHyA-Gruppe deutlich mehr neu gebildeter Knochen und deutlich weniger Restpartikel des avitalen Knochenersatzmaterials vorhanden.27

Vergleichbare Ergebnisse wurden in einer weiteren klinischen Vergleichsstudie bei externen Sinuslift-Operationen erhalten.28
Die Hyaluronsäure-Gruppe zeigte nach 6 Monaten eine signifikant bessere Knochenqualität als die Kontrollgruppe im Sinne eines höheren Anteils an neu gebildetem Knochen und weniger avitalen Restpartikeln.
Zudem war der Volumenerhalt des augmentierten Bereichs in der Hyaluronsäure-Gruppe signifikant besser als in der Kontrollgruppe (85,5% vs. 71,4%).
KLINISCHE EVIDENZ
Laterale Augmentation im posterioren Unterkiefer
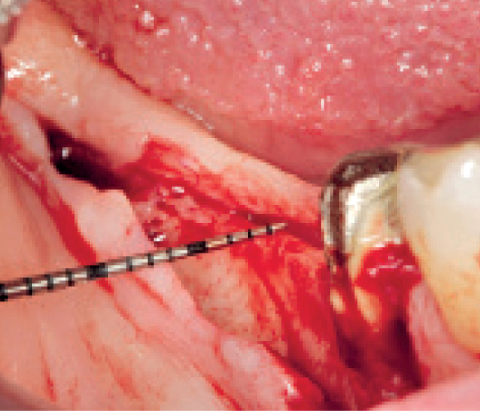
Prof. Božić
Kroatien
Augmentation eines Implantat-Dehiszenzdefekts mit „Sticky Bone“
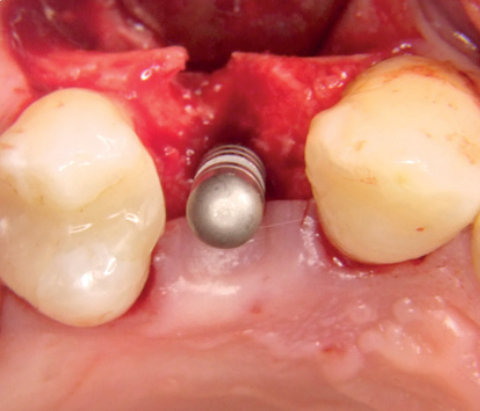
Dr. Müller-Busch
Deutschland
LITERATUR
- Benic, GI & Hämmerle, CH. Periodontology 2000 2014;66:13-40.
- Terheyden H. Implantologie 2011;19(4):359-366.
- Chiapasco M et al. Oral Maxillofac Surg Clin North Am 2011;23:1-15.
- Annen BM et al. Eur J Oral lmplantol 2011;4:87-100.
- Zellin G et al. Biomaterials 1995;16:601-609.
- Strietzel FP et al. Journal of Biomedical Materials Research Part B: Applied Biomaterials 2006;78:35-46.
- Schwarz F et al. International Journal of Oral and Maxillofacial Surgery 2007;36: 1198-1206.
- Mellonig JT et al. The International Journal of Periodontics & Restorative Dentistry 1998;18: 139-149.
- Mir-Mari J et al. Clin. Oral Impl. Res. 2016;27:258-265.
- Sculean A et al. Med Princ Pract. 2007;16(3):167-80.
- Hägi TT et al. Quintessence Int. 2014;45(3):185-92.
- Benic GI et al. Periodontology 2000 2014;66:13–40.
- Bashutski JD et al. Clin Adv Periodontics. 2011 Aug;1(2):80-87.
- Rajan P et al. Universal Research Journal of Dentistry. 2013;3:113.
- Saranraj P and Naidu MA. IJPBA, 2013;4(5):853–859.
- King SR et al. Surgery 1991;109(1):76-84.
- Yildirim S et al. J Periodontol. 2017;15:1-14.
- Pilloni A et al. Clin Oral Investig. 2018. doi: 10.1007/s00784-018-2537-4.Erratum in: Clin Oral Investig. 2018;22(8):2961-2962.
- Pirnazar P et al. J Periodontol 1999;70:370–374.
- Carlson GA et al. Biochem Biophys Res Commun. 2004;321(2):472-478.
- Mueller A et al. Clin Oral Investig. 2017;21(4):1013-1019.
- Asparuhova M et al. J Periodontal Res 2019;54:33–45.
- Sasaki T et al. Bone 1995;16(1):9–15.
- Mendes RM et al. Arch Oral Biol 2008;53:1155–1162.
- Eliezer M et al. J Periodontal Res. 2019;54(6):644-652.
- Kauffmann F et al. Manuscript in preparation.
- Hussein B et al. Manuscript in preparation.
- Stiller M. et al. Biomaterials 2014;35(10):3154-3163.
DOWNLOAD-BEREICH
| Broschüre SMARTGRAFT® | |
| Broschüre SMARTBRANE® | |
| Broschüre xHyA | |
| Fokusinfo Hyaluronsäure in der GBR |
nichtchirurgische pa-therapie
Frühe, wirksame Behandlung mit CLEAN&SEAL®
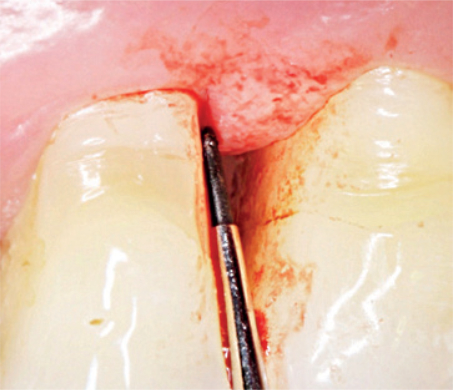
Parodontalerkrankungen sind Entzündungsreaktionen aufgrund einer bakteriellen Infektion, die hauptsächlich durch Bildung strukturierter pathogener Biofilme hervorgerufen wird. Auf eine Entzündung des parodontalen Weichgewebes folgt eine Resorption des Zahnhalteapparats.1 Insbesondere tiefe Taschen oder Furkationen begünstigen Biofilme, die die Entzündungsreaktion auslösen und somit das Risiko eines Zahnverlusts erhöhen.2
Die Kontrolle und Entfernung des Biofilms bilden den Grundbaustein eines erfolgreichen parodontalen Gesamtkonzeptes.2
CLEAN & SEAL® bietet ein Therapiekonzept für die nichtchirurgische Behandlung von Parodontitis.
BEHANDLUNG
Scaling/Root Planing mit CLEAN&SEAL®
Das CLEAN&SEAL® Konzept wurde auf der Basis von wissenschaftlichen Erkenntnissen als Unterstützung für die Behandlung und Kontrolle von periimplantärer Mukositis und Parodontitis entwickelt.3,4
CLEAN&SEAL® basiert auf einer gründlichen Entfernung des Biofilms durch mechanische Reinigung in Kombination mit der adjuvanten Anwendung eines Reinigungsgels (PERISOLV®) und anschließender Versiegelung des Defekts mit vernetzter Hyaluronsäure (xHyA), um eine erneute Infektion zu verhindern und Heilungsprozesse zu unterstützen.5

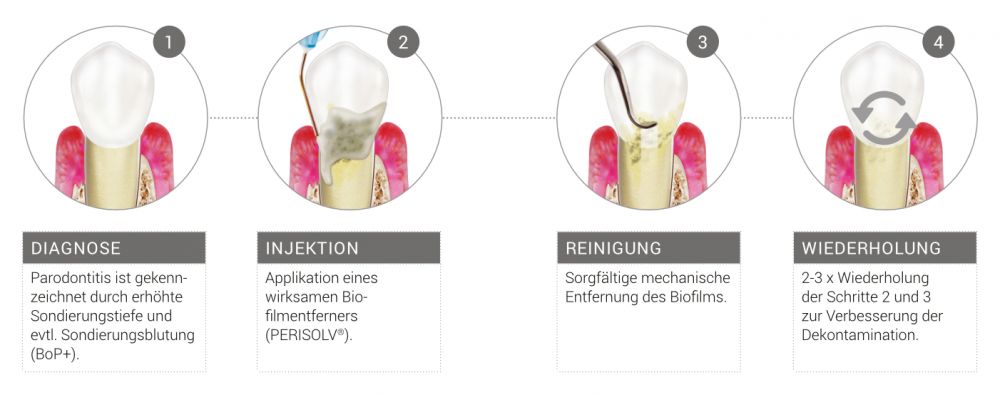
1. CLEAN
Reinigung des Defekts und der Wurzeloberfläche
Entscheidend für ein positives Behandlungsergebnis ist die Infektionskontrolle durch ein extensives Debridement zur gründlichen Entfernung des Biofilms.3,4
VORTEILE
- Aufweichen der extrazellulären Matrix des Biofilms6
- Verstärkung der Bakterienentfernung durch mechanisches Debridement
- Erleichterte Entfernung des Biofilms
2. SEAL
Versiegelung des Defekts und Unterstützung der Wundheilung mit Hyaluronsäure.
Erhöhung der Erfolgswahrscheinlichkeit durch die unterstützende Applikation schützender und regenerationsfördernder Versiegelungen, sowie durch regelmäßige Nachkontrollen zur Überwachung und Kontrolle der Entzündung.5
VORTEILE
- Stabilisierung und Schutz des Wundraums5,7,*
- Beschleunigte kontrollierte Wundheilung7-9
- Unterstützung der Knochenregeneration10-15
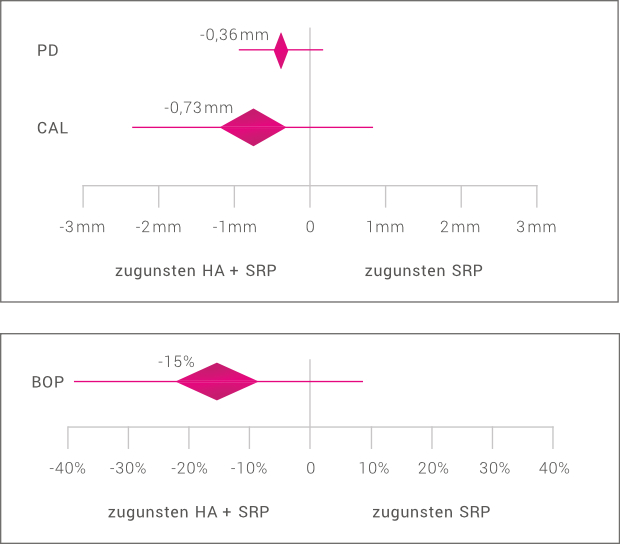
Hyaluronsäure (HA) vergrößert nicht nur die Oberflächenrauigkeit von Dentin, sondern begünstigt auch die Proliferation von PDL-Zellen.16 Durch die Anwendung von Hyaluronsäure nach mechanischer Instrumentierung (Scaling/Root Planing: SRP) können die parodontalen Parameter im Vergleich zur SRP-Behandlung allein verbessert werden.17,18 Ein Review mit Meta-Analyse zeigte, dass durch adjuvante Gabe von HA in der gewichteten mittleren Differenz aller ausgewerteten Studien im Vergleich zum SRP allein sowohl eine Verbesserung des klinischen Attachments (CAL: -0,73mm) als auch der Sondierungstiefe (PD: –0,36mm) erreicht werden kann.19
HA verbessert auch die lokalen Entzündungsparameter. Die Kombinationstherapie SRP/HA verringert das Sondierungsbluten (BOP) in der gewichteten mittleren Differenz um 15% im Vergleich zum SRP allein.
KLINISCHE EVIDENZ
Nicht-chirurgische Therapie eines tiefen intraossären Defekts mit CLEAN & SEAL®

Prof. Dr. Anton Friedmann
Deutschland
LITERATUR
- Page RC, Kornman KS. The pathogenesis of human periodontitis: an introduction. Periodontology 2000 1997; 14: 9–11.
- Renvert S et al. J Clin Periodontol. 2006; 33: 362-369.
- Jepsen S et al. J Clin Periodontol 2015;42(Suppl. 16):S152–S157.
- Costa FO et al. Journal of Clinical Periodontology 2012;39:173– 183.
- Pirnazar P et al. J Periodontol 1999;70:370–374.
- a) Jurczyk K et al. Clin Oral Investig.2016 Nov;20(8):2165-2173. Epub 2016 Jan 12. b) Iorio-Siciliano V et al. Clin Oral Investig. 2021 Mar 9. doi: 10.1007/s00784-021-03841-8. Epub ahead of print.
- Rajan P et al. Universal Research Journal of Dentistry. 2013;3:113.
- King SR et al. Surgery 1991;109(1):76-84.
- Yildirim S et al. J Periodontol. 2017;15:1-14.
- Pilloni A et al. Clin Oral Investig. 2018. doi: 10.1007/s00784-018-2537-4.
- Erratum in: Clin Oral Investig. 2018;22(8):2961-2962.
- Mueller A et al. Clin Oral Investig. 2017;21(4):1013-1019.
- Asparuhova M et al. J Periodontal Res 2019;54:33–45.
- Asparuhova M et al. Clin Oral Investig. 2020;24(11):3923-3937.
- Saranraj P and Naidu MA. IJPBA, 2013;4(5):853–859.
- Mueller A et al. Clin Oral Investig. 2017;21(4):1013-1019.
- Dahiya P et al. N Am J Med Sci 2013;5(5):309–315.
- de Brito BB et al. Clin Oral Implants Res 2012;23(8):938–942.
- Eliezer M et al. Clin Oral Investig. 2019;23(9):3423-3435.
DOWNLOAD-BEREICH
xHyA
vernetzte hyaluronsäure
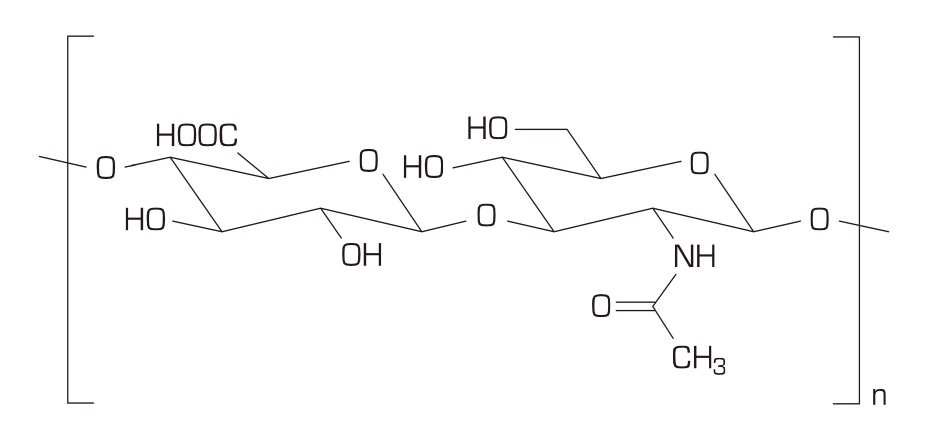
Hyaluronsäure (HA) ist eine physiologische Substanz und stellt eine der Hauptkomponenten der außerzellulären Matrix des Bindegewebes, der Gelenkflüssigkeit und vieler anderer Gewebe dar.1-3
Biochemisch betrachtet ist HA ein natürliches Polysaccharid-Makromolekül (geradkettiges Glycosaminoglykan).
PHYSIOLOGISCHE FUNKTIONEN VON HYALURONSÄURE
HA besitzt wichtige hygroskopische, rheologische und viskoelastische Eigenschaften und übt damit zahlreiche physiologische und strukturelle Funktionen aus.
Außer der vordringlichsten Aufgabe als „Schmiermittel“ in Gelenken spielt HA eine wichtige Rolle bei den grund- legenden regenerativen Prozessen, wie der Wundheilung und Embryogenese.
HA ist insbesondere bei solchen Situationen entscheidend, in denen eine schnelle Geweberegeneration und -reparatur erfolgen.4
Die einzelnen Funktionen der HA unterscheiden sich grundlegend in Abhängigkeit von der jeweiligen molekularen Größe (Kettenlänge).
Lange Hyaluronsäure-Ketten sind im Allgemeinen durch ihre immunsuppressiven, antiangiogenen und entzündungshemmenden Eigenschaften an der Modulation der Immunreaktion beteiligt. Kürzere Hyaluronsäure-Ketten sind dahingegen relevant für die Wund- und Gewebeheilung, da sie angiogene, immunstimulierende und inflammatorische Eigenschaften aufweisen.4,5
ANWENDUNGSGEBIETE
Umfangreiche Studien haben gezeigt, dass HA ein ideales Biomaterial für kosmetische, medizinische und pharmazeutische Anwendungen darstellt.
Neben ihrer ausgeprägten regenerativen Wirkung bindet HA Flüssigkeiten (1g Hyaluronsäure kann bis zu 6l Wasser aufnehmen).6 Durch die stark viskose Konsistenz unterstützen HA-Gele bei chirurgischer Anwendung die Wundraumstabilisierung. Je nach Indikation und angestrebter Funktion wird HA entweder in natürlicher Form oder mit zusätzlicher Kreuzvernetzung verwendet. Natürliche Hyaluronsäure weist das höchste regenerative Potenzial auf. Sie wird innerhalb von wenigen Stunden bis zu einigen Tagen in vivo abgebaut. Durch Vernetzung von natürlicher HA kann das Abbauverhalten bis zu mehreren Monaten verlängert werden. Allerdings wird vernetzte HA durch Reduzierung ihrer physiologischen Eigenschaften mehr und mehr inert.
KONZEPT
Optimiert für den regenerativen Behandlungserfolg
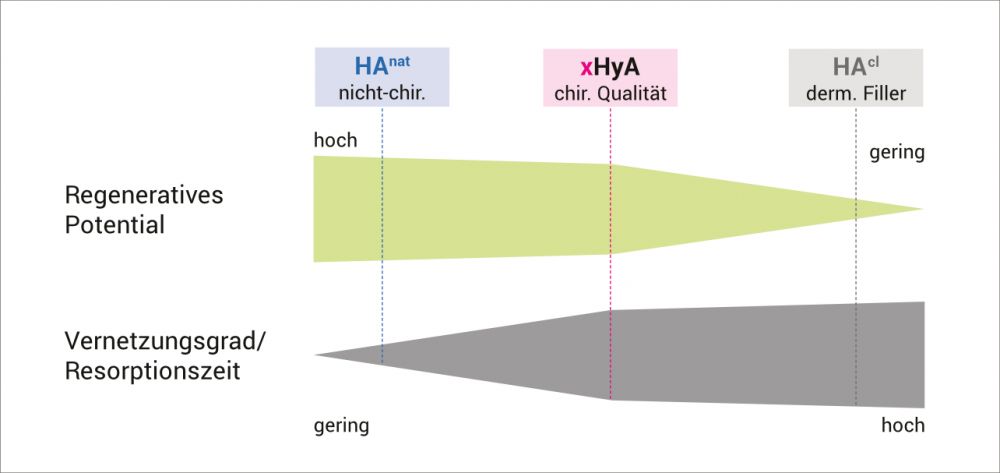
Vernetzte Hyaluronsäure in pharmakologischer Qualität (xHyA) zeichnet sich durch ein langsames Resorptionsprofil aus (mehrere Wochen) und grenzt sich somit von konventionellen Hyaluronsäure-Präparaten ab.
Diese weisen entweder einen deutlich höheren Vernetzungsgrad und somit ein längeres Abbauprofil auf (z.B. dermale „Filler“ in der Ästhetischen Chirurgie) oder sind nicht vernetzt und werden sehr schnell resorbiert (z.B. nicht-chirurgische HA-Präparate für die topische Anwendung).
Durch die Kombination von HA-Kettenlänge und speziell eingestellten Vernetzungsgrad wird bei xHyA das große regenerative Potenzial natürlicher Hyaluronsäure erhalten. Zugleich wird gewährleistet, dass xHyA nach Applikation nicht zu schnell abgebaut wird, und so während der verschiedenen Phasen des Heilungsprozesses präsent ist.7 Studien haben gezeigt, dass die verlängerte Anwesenheit von Hyaluronsäure während des Heilungsprozesses die Heilung durch Regeneration und nicht durch Reparation fördert.8-11
Vorteile
- Beschleunigte kontrollierte Wundheilung
- Stabilisierung und Schutz des Wundraums
- Unterstützung der Geweberegeneration
TECHNOLOGIE
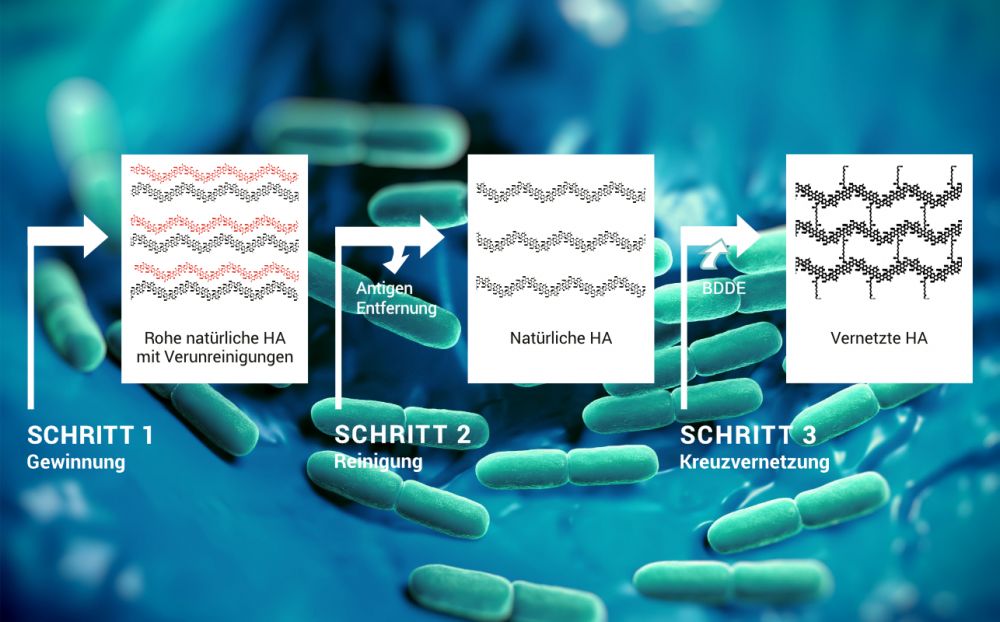
Schritt 1: Gewinnung
Reine Hyaluronsäure ist bei allen Spezies gleich,4 was die Gewinnung für die exogene Anwendung erleichtert. Traditionell wird HA aus Hahnenkämmen und der Augenflüssigkeit von Rindern extrahiert. HA bildet allerdings einen Komplex mit anderen Makromolekülen, sodass die Isolation einer bestimmten HA-Qualität aus diesen Quellen schwierig zu bewerkstelligen ist. Infolgedessen weist die HA tierischer Herkunft eine variierende Zusammensetzung auf.12 Zudem wird der Verwendung von tierischen Substanzen für die Behandlung beim Menschen wachsender Widerstand aufgrund ethischer Argumente und möglichem Risiko einer Virus-Infektion entgegengebracht.
Moderne Technologien, HA zu gewinnen, basieren auf der Anwendung eines bakteriellen Fermentationsprozesses ohne die Verwendung tierischer Gewebe.13
Bei der biotechnologisch hergestellten HA können die polymeren Eigenschaften sehr genau kontrolliert werden. Dies ermöglicht eine homogene HA-Zusammensetzung auf sichere und umweltfreundliche Art.
Schritt 2: Reinigung
Die sorgfältige Aufreinigung der so gewonnenen Hyaluronsäure spielt eine entscheidende Rolle dabei, zurückgebliebene bakterielle Proteine zu entfernen. Letztere können antigene Eigenschaften aufweisen und so eine Empfängerreaktion hervorrufen.14
Schritt 3: Kreuzvernetzung
Während natürliche HA-Komponenten im Allgemeinen einem schnellen Abbau unterliegen, benötigen viele erfolgreiche Therapieverfahren eine längere Verweildauer im Körper. Um das Resorptionsprofil der HA-Derivate zu verlängern, wird natürliche HA mittels bewährter chemischer Technologien vernetzt. Der Grad der Vernetzung beeinflusst sowohl die Abbauzeit als auch die physiologische Wirksamkeit. Die etablierteste Methode ist die Anwendung von BDDE (Butandioldiglycidylether) als Vernetzungs-Agens. Die Kehrseite der Verwendung von BDDE besteht darin, dass Rückstände im HA-Implantat Nebenwirkungen hervorrufen können. Daher ist die sorgfältige Reinigung von vernetzter HA elementar.15
LITERATUR
- Lee JY, Spicer AP. Curr Opin Cell Biol 2000;12:581–586.
- McDonald J, Hascall VC. JBiol Chem 2002;277:4575–4579.
- Jiang D et al. Physiol Rev 2011;91:221–264.
- Kessiena L et al. Wound Rep Reg 2014;22:579-593.
- Deed R et al. Int J Cancer, 1997;71:51-56.
- Rajan P et al. Universal Research Journal of Dentistry. 2013;3:113.
- De Boulle K et al. Dermatologic Surgery 2013;39(12):1758-1766
- Longaker T et al. Ann Surg 1991;April:292-296.
- Mast BA et al. Matrix, 1993;13:441-446.
- Asparuhova MB et al. J Periodont Res. 2018;00:1-13.
- Salbach J et al. J Mol Med 2012;90:625-635.Sculean A et al. Med Princ Pract. 2007;16(3):167-80.
- Kitchen JR et al. Biochem J 1995;309:649–656.
- Saranraj P and Naidu MA. IJPBA, 2013;4(5):853–859.
- André, P. J Europ Acad Dermatol Venereol 2004;18:422–425.
- De Boulle K et al. Dermatologic Surgery 2013;39(12):1758-1766.
DOWNLOAD-BEREICH
| Broschüre xHyA |

