THE GRAFT™
Natürlicher Knochenaufbau

THE Graft™ ist ein natürliches mineralisiertes Knochenaufbaumaterial aus deproteinisierter porciner Spongiosa. Durch seine Herkunft weist THE Graft™ eine größtmögliche strukturelle Ähnlichkeit zu humanem Gewebe auf.1,2
Gewebe porciner Herkunft besitzen generell eine hohe Biokompatibilität.1 Durch den patentierten Herstellungsprozess werden organische Bestandteile als potentielle immunogene Bestandteile sehr effektiv entfernt und zugleich die einzigartige Materialstruktur optimal erhalten.3

VORTEILE
OPTIMALER VOLUMENERHALT
Die einzigartige natürliche Struktur der porcinen Spongiosa gewährleistet die Defektstabilisation und verbessert die Knochenregeneration.4
Durch den patentierten Herstellungsprozess werden organische Bestandteile hocheffizient entfernt und das Knochenmineral ohne Veränderung der natürlichen Zusammensetzung konserviert.
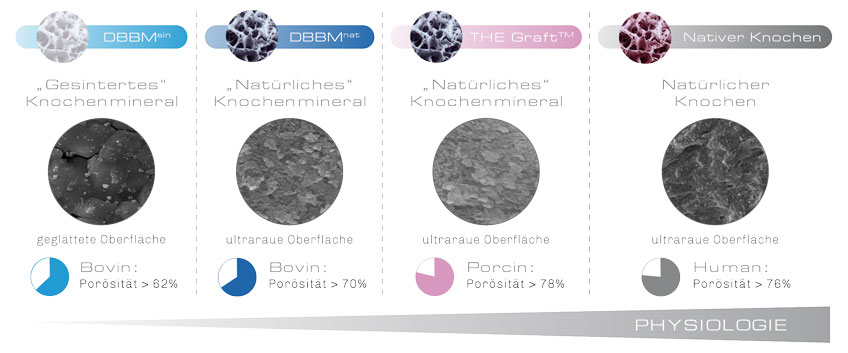
Der Aufbereitungsprozess ist so konzipiert, dass die natürliche Morphologie, insbesondere die komplexe ultraraue Oberflächenstruktur von natürlichem porcinem Knochen, optimal erhalten bleibt. Dadurch besitzt THE Graft™ eine höhere spezifische Oberfläche als in der Klinik etablierte natürliche bovine Knochenersatzmaterialien.
Die spezifische Oberfläche von hochtemperaturbehandelter (gesinterter) boviner Knochenmatrix ist im Gegensatz zu THE Graft™ sogar mehr als 100-fach kleiner.3
Materialoberfläche
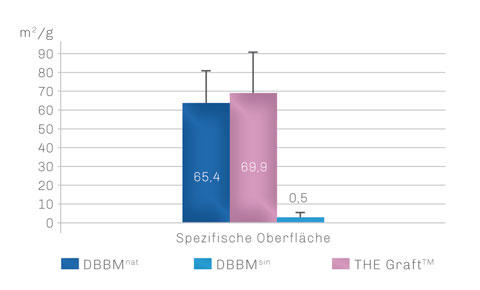
THE Graft™ weist eine höhere Materialoberfläche auf als natürliches DBBM. Die Oberfläche von hochgesintertem DBBM ist im Vergleich dazu deutlich verkleinert.
Dieser signifikante Unterschied der Oberflächenmorphologie kann durch hochauflösende elektronenmikroskopische Aufnahmen der Materialien sichtbar gemacht werden.3,4 Während THE Graft™ und natürliche bovine Knochenmatrix eine bis in den Nanobereich hochporöse Struktur aufweisen, zeigt hochtemperaturbehandeltes DBBM aufgrund der Sinterung eine deutlich veränderte Oberflächenstruktur mit weniger Poren und hohen Korngrößen. Gerade im für die Zelladhäsion relevanten Mikro- und Nano-Bereich5 ist eine deutliche „Glättung“ der Oberfläche zu erkennen.

REM Analyse für THE Graft™ zeigt ultra-raue Oberflächenstruktur als Indiz für eine natürliche Morphologie, die Oberflächenstruktur von gesintertem DBBM ist im Vergleich dazu deutlich verändert (weniger diffus).
Das große klinische Potential von THE Graft™ wurde in mehreren randomisierten klinischen Vergleichsstudien bestätigt.
So wurden zweizeitige Sinuslift-Operationen entweder mit THE Graft™ oder mit DBBMnat aufgefüllt und die Defekte mit einer Kollagenmembran abgedeckt.6
Es konnte kein signifikanter Unterschied zwischen beiden Augmentationsmaterialien hinsichtlich Defektauffüllung und Volumenerhalt festgestellt werden. So waren die augmentierten Sinus-Defekte mit THE Graft™ nach 6 Monaten genauso volumenstabil wie die mit dem Behandlungsstandard DBBMnat. Trotz vergleichbarer Volumenstabilität zeigte die Gruppe mit THE Graft™ zu diesem Zeitpunkt mehr neu gebildeten Knochen und weniger Restpartikel als die DBBM-Gruppe.
Vergleichbare Ergebnisse wurden in einer weiteren klinischen Vergleichsstudie beobachtet, bei der defekte Extraktionsalveolen entweder mit DBBMnat oder mit THE Graft™ aufgefüllt wurden und zur Abdeckung eine native Kollagenmembran verwendet wurde.7
Beide Gruppen zeigten nach 4 Monaten einen vergleichbaren Volumenerhalt mit einer leichten horizontalen und vertikalen Resorption, die sogar leicht ausgeprägter in der DBBMnat-Gruppe war (Verlust horizontal: THE Graft™ vs. DBBMnat: 1,43 ± 3,40 mm vs. 1,83 ± 2,85 mm / Verlust vertikal: THE Graft™ vs. DBBMnat: 1,22 ± 2,16 mm vs. 1,45 ± 1,92 mm – statistisch nicht signifikant).
STABILITÄT DES AUGMENTATS NACH 6 MONATEN
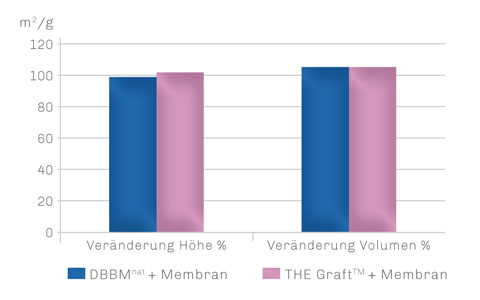
Sowohl mit DBBMnat als auch mit THE Graft™ wird nach 6 Monaten eine hohe Volumenstabilität des Augmentats erzielt.
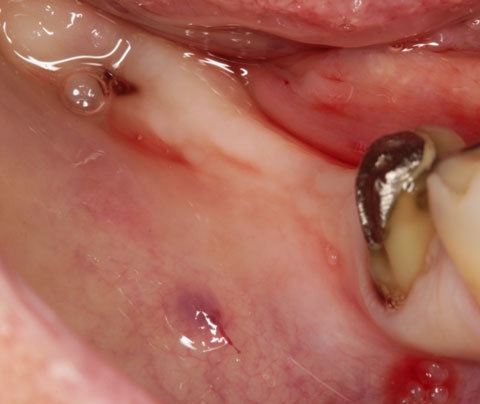
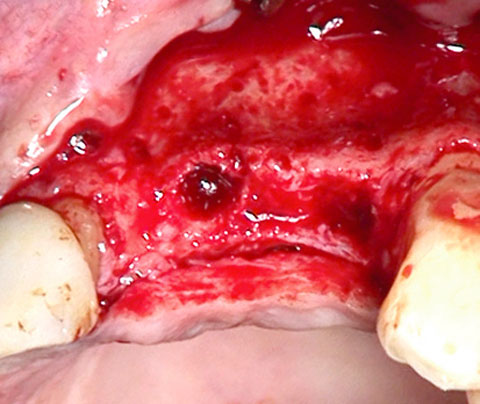
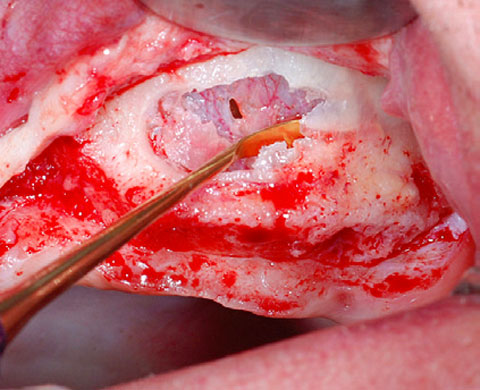
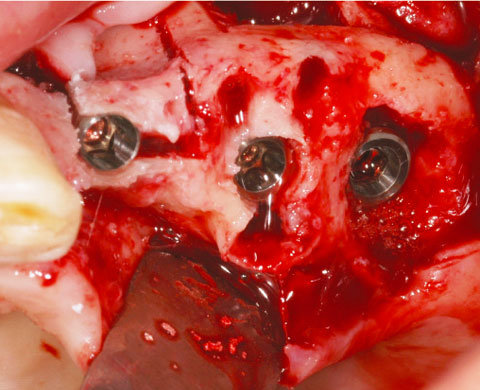
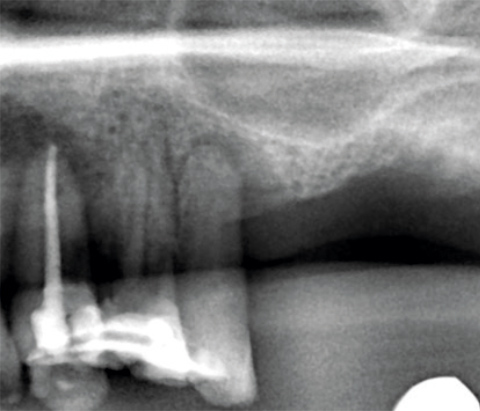
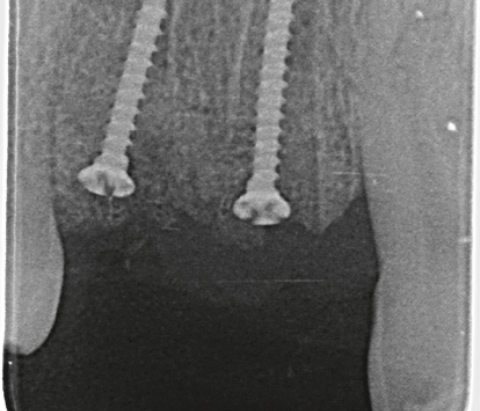
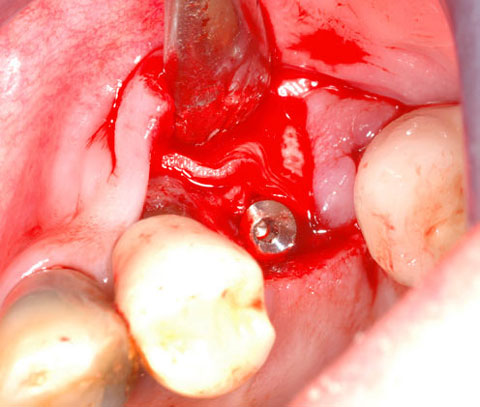
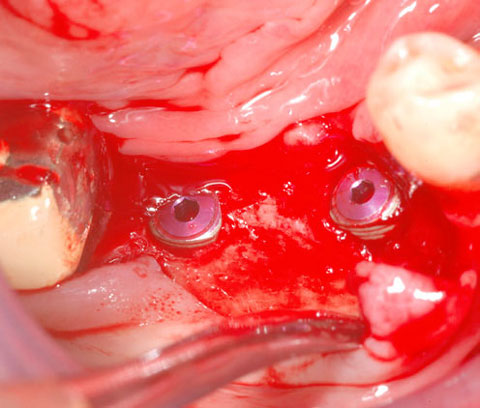
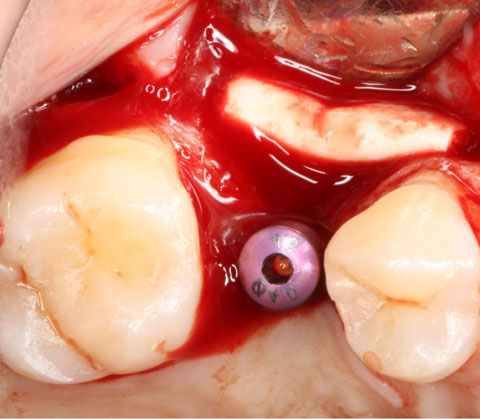
Ein lokaler dreidimensionaler Defekt würde normalerweise mit technikempfindlichen Knochenblöcken behandelt werden.
Durch die Verwendung einer OSSIX® Plus-Membran mit einer Titanschraube als stützender „Zeltstange“ (tent-pole) konnte Randelzhofer zeigen, dass sich derartige Defekte auch durch die Kombination mit partikulärem Knochenersatzmaterial regenerieren lassen.3
KNOCHENQUALITÄT 6 MONATE POST-OP SINUS LIFT
Nach 6 Monaten weist die THE Graft™-Gruppe einen höheren Anteil an neu gebildetem Knochen und weniger Restpartikel auf als die DBBMnat-Gruppe.
STEIGERUNG DER EFFIZIENZ
Kombinierte natürliche Makro-, Mikro- und Nanoporosität der porcinen Knochenmatrix verbessert die klinische Performance.4
Durch den porcinen Ursprung weist THE Graft™ eine große Ähnlichkeit zu humanem Gewebe auf.1 Es besitzt eine größtmögliche Porosität gepaart mit einer natürlichen Interkonnektivität.4
THE Graft™ weist mit 78,4% eine größere Porosität auf als entsprechende Präparate bovinen Ursprungs (62%-70,5%), und erreicht so das Niveau von humanem Knochen (76,5%).4,8,9
Diese hohe Porosität hat auch einen positiven Effekt auf das Schüttvolumen von THE Graft™. Eine 1g-Packung von THE Graft™ ergibt ca. 2,4cc (0,25-1mm Partikelgröße). Das entspricht ca. 20% mehr Material als beim Standard boviner natürlicher Knochenmineralien (ca. 2,0cc/g) und sogar ca. 50% mehr als bei einem hochtemperaturbehandelten bovinen Knochenmineral (ca. 1,6cc/g).4
Durch die große Porosität von THE Graft™ erfolgt eine schnellere Aufnahme von Flüssigkeiten bzw. Blut, v.a. im Vergleich zu natürlichem DBBM.4 Dies erleichtert nicht nur die Applikation des Materials, sondern führt auch zu einer besseren Inkorporation nach Implantation.
Eine histomorphometrische Analyse der Knochenqualität 4 Monate nach Augmentation von defekten Extraktionsalveolen zeigte vergleichbare Anteile an restlichem Biomaterial für THE Graft™ bzw. DBBMnat (12,21 ± 5,75% bzw. 12,37 ± 5,67%).10
In der THE Graft™-Gruppe wurde allerdings ein leicht höherer Anteil an neu gebildetem Knochen im Vergleich zu DBBMnat gefunden (18,47 ± 11,47% i.Vgl. zu 15,07 ± 10,52%).*
Eine genauere Analyse der histologischen Befunde zeigte eine deutlich stärkere Inkorporation der THE Graft™-Partikel in neu gebildeten Knochen im Vergleich zum bovinen Standard.
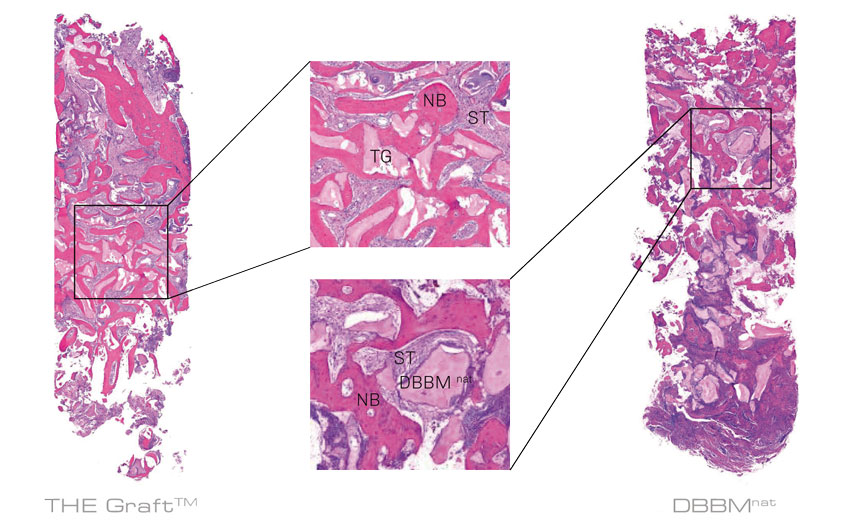
Nach 6 Monaten weist die THE Graft™- Gruppe einen höheren Anteil an neu gebildetem Knochen und weniger Restpartikel auf als die DBBMnat-Gruppe.
TG: THE Graft™; NB: Neu gebildeter Knochen, ST: Weichgewebe.
* statistisch nicht signifikant
SICHER & BIOKOMPATIBEL
Optimiertes Sicherheits- und Biokompatibilitätsprofil
Die Kombination aus porciner Herkunft und hohem Reinheitsgrad ermöglicht ein vorhersagbares Knochenwachstum ohne das Risiko einer imunogenen Reaktion.
Hinsichtlich physikalischer und chemischer Zusammensetzung besitzt THE Graft™ aufgrund seines porcinen Ursprungs größtmögliche Ähnlichkeit zu humanem Knochen.11 Dadurch ergeben sich optimale Voraussetzungen für eine verbesserte Biokompatibilität und Regenerationsfähigkeit, vor allem gegenüber bovinem Gewebe.
Zudem entfällt aufgrund des porcinen Ursprungs die Aufklärungspflicht gegenüber dem Patienten betreffend der potentiellen Gefahr einer Übertragung von BSE- (Bovine Spongiforme Enzephalopathie) bzw. Creutzfeld-Jacob-Erregern.12
Durch das sehr effiziente patentierte Herstellungsverfahren wird THE Graft™ zudem gründlich von organischen Bestandteilen gereinigt, die potentielles Infektionsrisiko und immunogenes Potential aufweisen könnten.13
Dies wird durch eine Rückstandsanalytik auf Proteinreste deutlich. So zeigt THE Graft™ im Vergleich zum bovinen Standard natürlicher boviner Knochenmineralien einen um 10-fach geringeren Aminosäuregehalt auf.3 Solch niedrige Werte für organische Rückstände finden sich sonst nur bei hochtemperaturbehandeltem KEM, welche jedoch auf Kosten der natürlichen Knochenstruktur erzielt werden.
AMINOSÄUREGEHALT
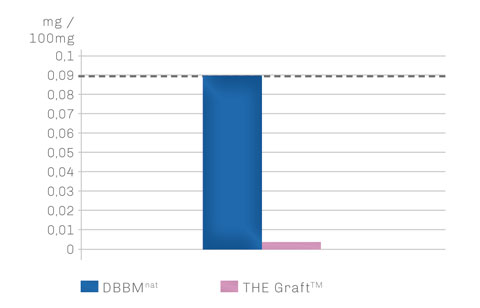
Rückstandsanalytik von THE Graft™ zeigt deutlich verminderten Restaminosäuregehalt im Vergleich zum etablierten DBBMnat.
Die hohe Biokompatibilität von THE Graft™ wird im in vitro-Zellversuch deutlich.3 So begünstigt THE Graft™ die Zelladhäsion in gleichem Maße wie etabliertes natürliches DBBM und bietet optimale Bedingungen für vitales Zellwachstum.
ZELLVITALITÄT
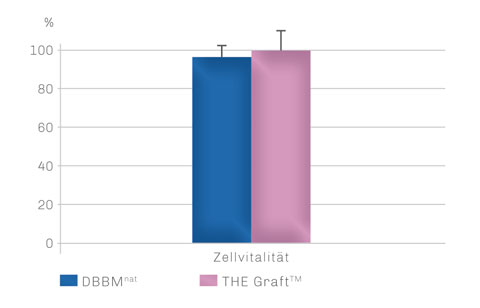
THE Graft™ weist vergleichbare Biokompatibilität zu Zellen auf wie natürliches DBBMnat.
PRODUKTE

| Artikelnummer | Granulat | Menge | ||
| 0114.131 | 250–1000µm | 0,25g / 0,6cc | ||
| 0114.132 | 0,5g / 1,2cc | |||
| 0114.133 | 1,0g / 2,4cc | |||
| 0114.134 | 2,0g / 4,8cc | |||
| 0114.142 | 1000–2000µm | 0,5g / 1,8cc | ||
| 0114.143 | 1,0g / 3,6cc |
INDIKATIONEN

THE Graft™ kann u.a. bei folgenden Indikationen verwendet werden:
| Augmentation von periimplantären Defekten (z.B. Dehiszenz- und Fenestrationsdefekte um Implantate) |
 |
|
| Auffüllung von Extraktionsalveolen |  |
|
| Sinus-Lift |  |
|
| Auffüllung von Knochendefekten (z.B. nach Wurzelspitzenresektion oder Cystektomie) |
 |
|
| Aufbau oder Rekonstruktion des Kieferkamms (Guided Bone Regeneration „GBR“ — z.B. Aufbau in lateraler/horizontaler Dimension) |  |
|
| Auffüllung parodontaler Knochendefekte (z.B. intraossäre oder Furkationsdefekte) |
 |
KLINISCHE EVIDENZ
TECHNOLOGIE
Deproteinisiertes Knochenmineral wird aus Spongiosaknochen tierischen Ursprungs hergestellt
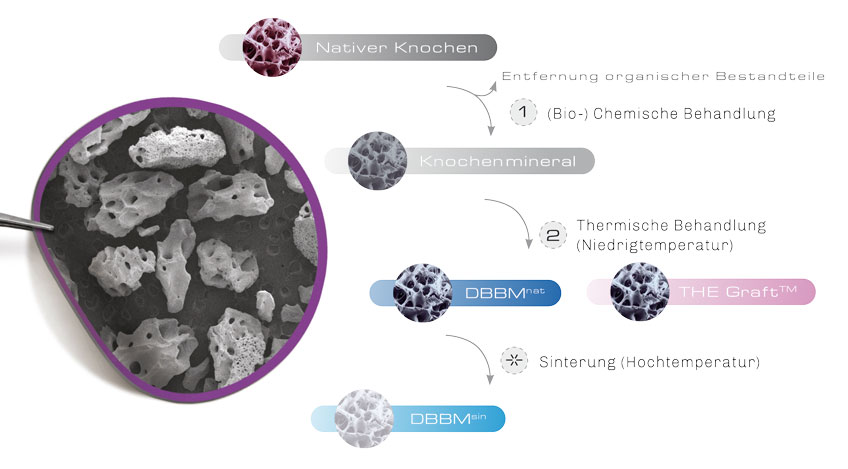
1. (Bio-) Chemische Behandlung
Im ersten Schritt erfolgt eine (bio-)chemische Behandlung. Hierdurch wird der native Knochen von organischen Bestandteilen befreit. Somit werden potentiell immunogene Bestandteile wie Proteine, Zell- und DNA-Reste aus der Knochenmatrix entfernt.13 Zudem werden vorhandene Pathogene des Ausgangsgewebes wie z.B. Viren und Bakterien entfernt und inaktiviert.
Das so gewonnene „rohe“ Knochenmineral besteht im Wesentlichen aus biologischem Hydroxylapatit. In Abhängigkeit vom tierischen Ursprung weist das Knochenmineral in diesem Zustand eine dem humanen Knochen ähnelnde Oberflächenmorphologie sowie ein vergleichbares Porensystem mit optimaler Porengröße auf.
2. Thermische Behandlung (Niedrigtemperatur)
Anschließend wird das Knochenmineral thermisch behandelt. Dies bewirkt, dass die Mineralstruktur zunehmend kristalliner wird und so eine höhere biomechanische Stabilität erhält. In Abhängigkeit von der Temperatur ändern sich die morphologischen Eigenschaften des Knochenminerals.5 Bei Niedrigtemperaturbehandlung behält das Knochenmineral sowohl die natürliche Zusammensetzung als auch die natürliche Morphologie (Oberflächenstruktur und Porosität) und somit die große strukturelle Ähnlichkeit zum natürlichen Knochen. THE Graft™ wird wie der heutige Standard der bovinen KEM mit Temperaturen unter dem Sinterpunkt behandelt.
*. Sinterung (Hochtemperatur)
Bei der Anwendung von höheren Temperaturen wie es bei zahlreichen angebotenen KEM der Fall ist, wird das Knochenmineral zwar zunehmend stabiler, allerdings erfolgt eine „Sinterung“ der Mineralkristalle. Dies führt zu einer signifikanten Änderung der Morphologie, einer Glättung der Oberfläche, sowie dem Verlust von Mikro- und Nanoporosität.2,5
Neben der Herstellungsmethodik hat auch die Herkunft des Gewebes einen großen Einfluss auf die Materialeigenschaften. Aufgrund seines porcinen Ursprungs besitzt THE Graft™ eine größere Ähnlichkeit zu humanem Knochen als vergleichbare Präparate bovinen Ursprungs.1,2 Dies bringt optimale Voraussetzungen für verbesserte Biokompatibilität und Regenerationsfähigkeit mit sich.
LITERATUR
- Pearce A, Richards RG, Milz S, Schneider E, Pearce SG. European Cells and Materials 2007;13:1-10.
- Figueiredo M, Fernando A, Martins G, Freitas J, Judas F, Figueiredo H. Ceramics International 2010;36:2383–2393.
- Lee J-H, Lee E-U, Zhang M-L, Lim H-C, Kim Y-T, Lee J-S, Jung U-W, Choi S-H. Biomater. Res. 2013;17(4):160-167.
- Lee JH, Yi GS, Lee JW, Kim DJ. J Periodontal Implant Sci. 2017;47(6):388-401.
- Dorozhkin SV. BIO 2011;1:1-51.
- Lee JS, Shin HK, Yun JH, Cho KS. Clin Implant Dent Relat Res. 2017;19(1):140-150.
- Lee JS, Cha JK, Kim CS. Clin Implant Dent Relat Res. 2018;20(5):729-737.
- Tadic T, Epple M. Biomaterials 2004;25:987–994.
- Vanis S, Rheinbach O, Klawonn A, Prymak O, Epple M. Mat.-wiss. U. Werkstofftech. 2006;37(6):469-473.
- Koo TH, Song YW, Cha JK, Jung UW, Kim CS, Lee JS. Clin Oral Implants Res. 2020;31(1):93-102.
- Kropp B, Chevalier Y, Müller PE, Pietschmann MF. Deutscher Kongress für Orthopädie und Unfallchirurgie (DKOU). 2015. DocPO24-1680 doi:10.3205/15dkou749, urn:nbn:de:0183-15dkou7494
- Kim Y, Nowzari H, Rich SK. Clin Implant Dent Relat Res 2013;15(5):645-653.
- Fretwurst T, Spanou A, Nelson K, Wein M, Steinberg T, Stricker A. Oral Surg Oral Med Oral Pathol Oral Radiol 2014;118:424-431.
DOWNLOAD-BEREICH
| Broschüre THE Graft | |
| Fokusinfo Porcin vs. Bovin |
SMARTGRAFT
Natürliche Knochenregeneration

SMARTGRAFT ist ein natürliches mineralisiertes Knochenaufbaumaterial aus deproteinisierter porciner Spongiosa. Durch die porcine Herkunft weist SMARTGRAFT eine größtmögliche strukturelle Ähnlichkeit zu humanem Gewebe auf.1,2
Gewebe porciner Herkunft besitzen generell eine hohe Biokompatibilität.2 Durch den firmeneigenen Herstellungsprozess werden organische Bestandteile als potentielle immunogene Bestandteile sehr effektiv entfernt und zugleich die ursprüngliche Materialstruktur des natürlichen resorbierbaren Carbonatapatits erhalten.3

VORTEILE
NATÜRLICHE KNOCHENREGENERATION
Kombinierte natürliche Makro-, Mikro- und Nanoporosität der aufgereinigten porcinen Knochenmatrix verbessert die klinische Performance.3
Die Porosität ist generell ein Schlüsselmerkmal für die Performance von Knochenersatzmaterialien: eine hohe offene Porosität im Makrobereich ist wichtig für die Gefäßneubildung, während eine hohe Mikroporosität des Materials die Osteokonduktivität unterstützen kann.1,4,5
Durch den speziellen Aufbereitungsprozess von SMARTGRAFT wird die große kombinierte natürliche Makro-, Mikro- und Nanoporosität von porciner Knochenmatrix erhalten. So erfolgt eine noch schnellere Aufnahme von Flüssigkeiten, bzw. Blut, v.a. im Vergleich zu natürlichem DBBM.1,3
Knochenersatzmaterial aus bovinem Knochenmineral wird lediglich in neu gebildeteten Knochen eingebaut.
Im Gegensatz dazu durchläuft autogener und allogener Knochen darüber hinaus ein Remodeling, sodass Knochenpartikel vollständig zu vitalem Knochen umgebaut werden können.
Porcines Gewebe weist eine größere Ähnlichkeit zu humanem Gewebe auf, als es bei bovinem Gewebe der Fall ist.2 So besitzt boviner Knochen eine deutlich niedrigere Porosität als humaner Knochen (62-70% i.Vgl. zu 76,5%).5-7
Porcine Knochenmatrix dahingegen weist eine größere Gesamtporosität auf als entsprechende Präparate bovinen Ursprungs.
MIKRO-CT ANALYSE
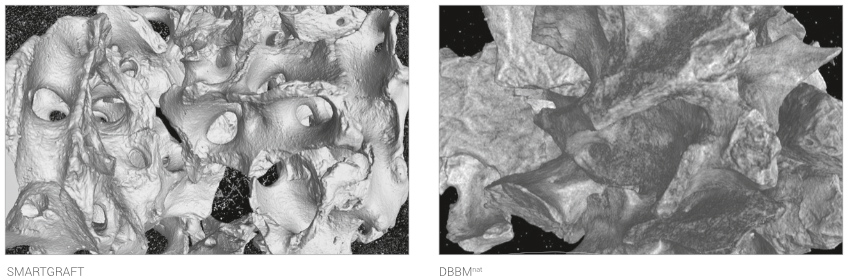
Mikro-CT Aufnahmen von SMARTGRAFT und DBBMnat zeigen den strukturellen Unterschied zwischen porcinem und bovinem Knochen: SMARTGRAFT ist deutlich poröser als DBBMnat.
SMARTGRAFT besitzt eine größtmögliche Porosität gepaart mit der natürlichen Interkonnektivität.3
So ist die Gesamtporosität von SMARTGRAFT Partikeln deutlich höher als bei DBBMnat, sowohl bei der Partikelgröße von 0,25-1 mm (88% i.Vgl. zu 78%) als auch bei der Partikelgröße von 1-2mm (95% i.Vgl. zu 88%).3
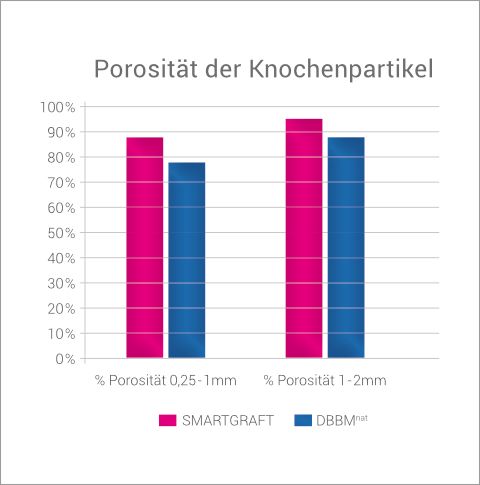
SMARTGRAFT weist eine höhere Porosität auf als natürliches DBBM.
Dies erleichtert nicht nur die Applikation des Materials, sondern führt auch zu einer besseren Inkorporation nach Implantation.
Ein hoher Sinterungsprozess bei hochtemperaturbehandelten bovinen Knochenersatzmaterialien DBBMsin führt zu einer Verkleinerung der Poren. Dadurch geht insbesondere die einzigartige Mikroporosität des nativen Knochens verloren, was eine Verringerung der Osteokonduktivität zur Folge hat.
Eine entscheidende Rolle für die biologische Abbaubarkeit von Hydroxylapatit spielt die Anwesenheit des schneller resorbierenden Carbonats, das Bestandteil der natürlichen Knochenmatrix ist.1,8-11
Durch die Temperaturbehandlung bei der Herstellung von natürlichem Knochenmineral besteht die Gefahr, dass der Carbonatanteil der natürlichen Knochenmatrix entfernt wird und so die Fähigkeit zum Umbau verloren geht.1
Bei der Herstellung von SMARTGRAFT und DBBMnat wird der natürliche Carbonatanteil und somit das Potential zu einem zellulären Umbau erhalten. Im Gegensatz dazu führt die Hochtemperaturbehandlung bei DBBMsin zu einem Verlust des Carbonats.
Dies wird in einer Analyse der Materialstruktur mit IR deutlich. Hier sind bei SMARTGRAFT und DBBMnat die charakteristischen Carbonat-Banden bei 1500nm und 900nm erkennbar. DBBMsin weist lediglich die Phosphat-Banden bei 110Onm und 600nm als Charakteristikum für den Apatit-Anteil auf.3
IR-ANALYSE
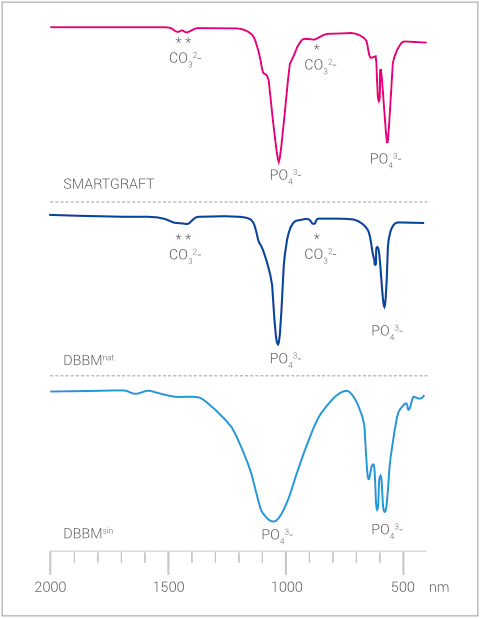
Vorhandene Carbonatstruktur bei SMARTGRAFT und DBBMnat als Zeichen der schonenden Herstellung. Beim hochtemperaturbehandelten DBBMsin ist kein Carbonat mehr vorhanden.
Das große regenerative Potential von SMARTGRAFT konnte in einer tierexperimentellen Untersuchung an Beagle-Hunden gezeigt werden, bei denen Extraktionsalveolen entweder mit DBBMnat oder mit SMARTGRAFT gefüllt wurden.
So war in der SMARTGRAFT Gruppe der Anteil an neu gebildetem Knochen höher als in der DBBMnat-Gruppe, sowohl nach 4 Wochen als auch nach 8 Wochen post-OP.3
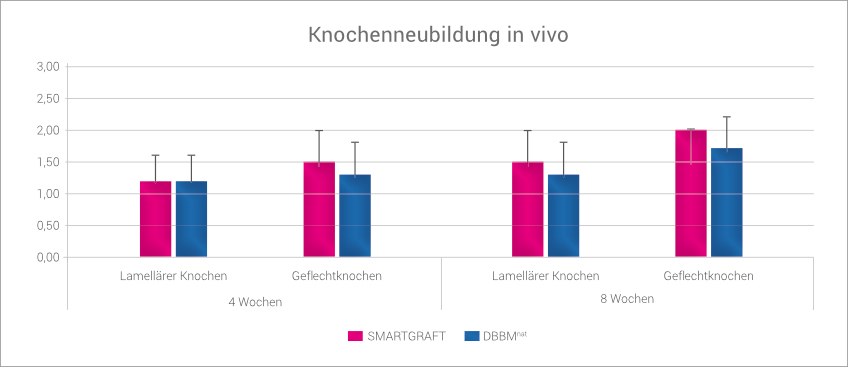
SMARTGRAFT-Gruppe zeigt mehr neu gebildeten Knochen als DBBMnat-Gruppe
OPTIMALER VOLUMENERHALT
Einzigartige natürliche Struktur - Gewährleistung der Defektstabilisation und natürliche Knochenregeneration.3
Durch den patentierten Herstellungsprozess werden organische Bestandteile, wie das im Knochen enthaltene Kollagen, hocheffizient entfernt und das natürliche Knochenmineral (Carbonatapatit) ohne Veränderung der natürlichen Zusammensetzung konserviert. SMARTGRAFT durchläuft während der Herstellung eine Niedrigtemperaturbehandlung vergleichbar wie DBBMnat.
Dadurch nimmt die Kristallinität der Knochenmatrix zu, was in vivo zu einer langsameren Resorption als bei autologem Knochen führt. Dadurch wird eine bessere Volumenstabilität des augmentierten Areals erzielt.12
Der Aufbereitungsprozess ist so gestaltet, dass die natürliche Morphologie, insbesondere die komplexe ultraraue Oberflächenstruktur von natürlichem porcinem Knochen, erhalten bleibt. Dadurch besitzt SMARTGRAFT eine höhere spezifische Oberfläche als in der Klinik etablierte bovine Knochenersatzmaterialien.
Die spezifische Oberfläche von hochtemperaturbehandelter boviner Knochenmatrix ist im Gegensatz zu SMARTGRAFT sogar um ein Vielfaches kleiner.3
Dieser signifikante Unterschied der Oberflächenmorphologie kann durch hochauflösende elektronenmikroskopische Aufnahmen der Materialien sichtbar gemacht werden.1,3
Während SMARTGRAFT und natürliche bovine Knochenmatrix eine bis in den Nanobereich hochporöse Struktur aufweisen, zeigt hochtemperaturbehandeltes DBBM aufgrund der Sinterung eine deutlich veränderte Oberflächenstruktur mit weniger Poren und hohen Korngrößen.
Gerade im für die Zelladhäsion relevanten Mikro- und Nano-Bereich13 ist eine deutliche „Verglättung" der Oberfläche zu erkennen.
REM-ANALYSE
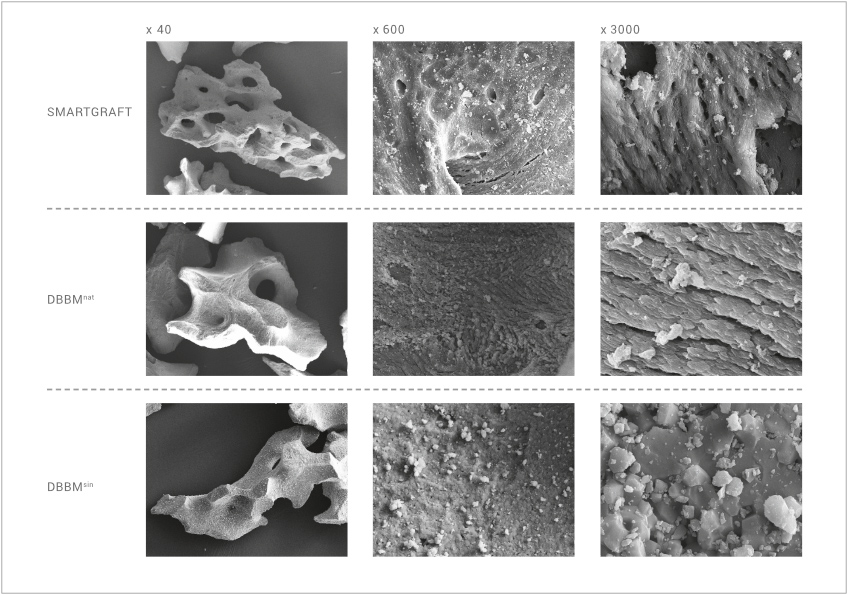
SMARTGRAFT besitzt eine höhere spezifische Oberfläche als in der Klinik etablierte bovine Knochenersatzmaterialien.
SICHER & BIOKOMPATIBEL
Optimiertes Sicherheits- und Biokompatibilitätsprofil durch die Kombination der porcinen Herkunft und des hocheffizienten Aufbereitungsprozesses.3
Die Kombination aus porciner Herkunft und dem hohen Reinheitsgrad ermöglicht ein vorhersagbares Knochenwachstum ohne das Risiko einer imunogenen Reaktion.
SMARTGRAFT ist ein deproteinisiertes natürliches Knochenmineral und weist, wie auch Präparate bovinen Ursprungs, ein langsames Resorptionsprofil auf. Aus diesem Grund wird im Vergleich zu autogenem bzw. allogenem Knochen eine verbesserte Volumenstabilität des augmentierten Areals erzielt.
Hinsichtlich physikalischer und chemischer Zusammensetzung besitzt SMARTGRAFT aufgrund seines porcinen Ursprungs größtmögliche Ähnlichkeit zu humanem Knochen.1,2
Dadurch ergeben sich optimale Voraussetzungen für eine verbesserte Biokompatibilität und Regenerationsfähigkeit, vor allem gegenüber bovinem Gewebe.
Aus diesem Grund wird SMARTGRAFT nach Augmentation zu einem stärkeren Maße in neuen Knochen umgebaut als es bei DBBM der Fall ist. Somit verbleiben bei SMARTGRAFT deutlich weniger Rest-/Fremdpartikel im neu gebildeten Knochen als bei DBBM.
VERGLEICH RESORPTIONSPROFIL
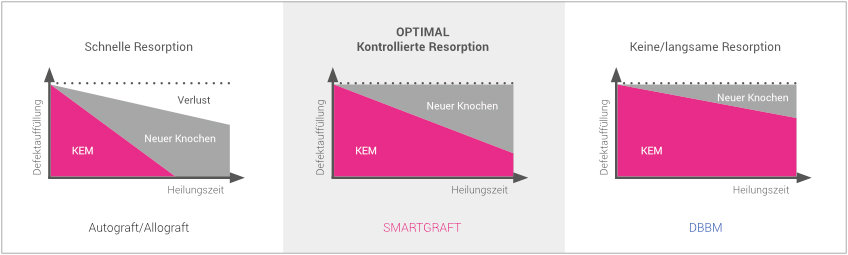
SMARTGRAFT weist ein kontrolliertes Resorptionsprofil auf.
Zudem entfällt aufgrund des porcinen Ursprungs die Aufklärungspflicht gegenüber Patienten zur potentiellen Gefahr einer Übertragung von BSE- (Bovine Spongiforme Enzephalopathie) bzw. Creutzfeld-Jacob-Erregern.14
Durch das sehr effiziente und patentierte Herstellungsverfahren wird SMARTGRAFT zudem gründlich von organischen Bestandteilen gereinigt, die potentielles Infektionsrisiko und immunogenes Potential aufweisen könnten.4
In einer tierexperimentellen Untersuchung wurden Femurkondylendefekte in Hasen mit SMARTGRAFT oder DBBMnat gefüllt und neben der Knochenneubildung auch die Biokompatibilität im Sinne von Fremdkörperreaktionen untersucht. 4 Wochen post-OP zeigten beide Präparate eine hohe Biokompatibilität. Es waren in beiden Gruppen histologisch sowohl keine Entzündungszeichen als auch nur ein sehr geringer Anteil an Fremdkörperriesenzellen auffindbar.3
BIOKOMPATIBILITÄT IN-VIVO
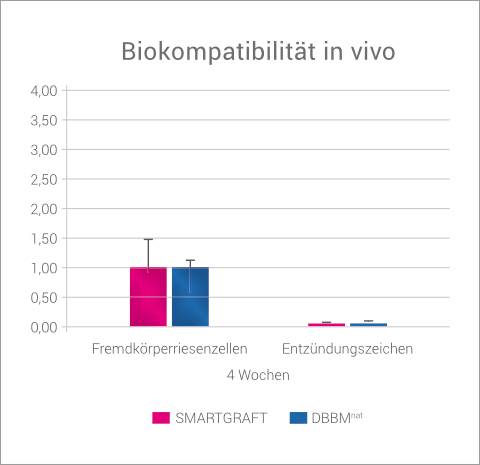
SMARTGRAFT zeigt vergleichbare Biokompatibilität in-vivo wie DBBMnat.
PRODUKTE
SMARTGRAFT
| Artikelnummer | Granulat | Menge | ||
| 0114.101 | 250–1000µm | 0,5cc | ||
| 0114.102 | 1,0cc | |||
| 0114.103 | 2,0cc | |||
| 0114.105 | 4,0cc | |||
| 0114.112 | 1000–2000µm | 1,0cc | ||
| 0114.113 | 2,0cc |
SMARTGRAFT Syringe
| Artikelnummer | Granulat | Menge | ||
| 0114.450 | 250–1000µm | 0,25cc | ||
| 0114.451 | 0,5cc |
INDIKATIONEN

SMARTGRAFT kann u.a. bei folgenden Indikationen verwendet werden:
| Augmentation oder Rekonstruktion des Alveolarkamms |  |
|
| Auffüllung von knöchernen Defekten in Kombination mit Produkten für die Guided Bone Regeneration (GBR) |  |
|
| Sinusbodenelevation |  |
|
| Auffüllung von Extraktionsalveolen zum besseren Erhalt des Alveolarkamms |  |
|
| Auffüllung von Defekten nach Wurzelspitzenresektion, Apicoektomie und Zystektomie |  |
|
| Auffüllung von intraossären parodontalen Defekten |  |
|
| Auffüllung von parodontalen Defekten in Kombination mit Produkten für die Guided Tissue Regeneration (GTR) und Guided Bone Regeneration (GBR) |  |
KLINISCHE EVIDENZ
Komplexe laterale und
vertikale Rekonstruktion in
der ästhetischen Zone
Dr. Frederic Kauffmann
Deutschland
TECHNOLOGIE
Deproteinisiertes Knochenmineral wird aus Spongiosaknochen tierischen Ursprungs hergestellt
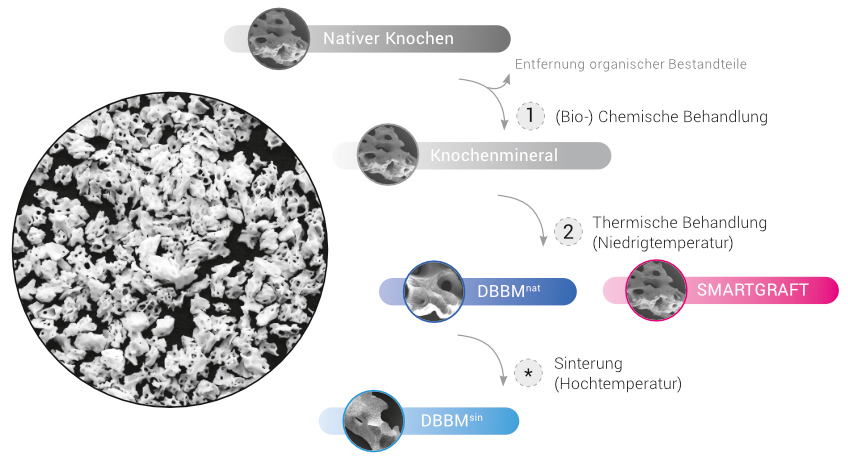
1. (Bio)Chemische Behandlung
Im ersten Schritt erfolgt eine (bio-) chemische Behandlung. Hierdurch wird der native Knochen von organischen Bestandteilen befreit. Somit werden potenziell immunogene Bestandteile wie Proteine, Zell- und DNA-Reste aus der Knochenmatrix entfernt.11 Zudem werden vorhandene Pathogene des Ausgangsgewebes, wie z.B. Viren und Bakterien, entfernt und inaktiviert. Das so gewonnene „rohe“ Knochenmineral besteht im Wesentlichen aus biologischem Carbonatapatit. In Abhängigkeit vom tierischen Ursprung weist das Knochenmineral in diesem Zustand eine dem humanen Knochen ähnelnde Oberflächenmorphologie, sowie ein vergleichbares Porensystem mit optimaler Porengröße auf.
2. Thermische Behandlung (Niedrigtemperatur)
Anschließend wird das Knochenmineral thermisch behandelt. Dies bewirkt, dass die Mineralstruktur zunehmend kristalliner wird und so eine höhere biomechanische Stabilität erhält. In Abhängigkeit von der Temperatur ändern sich die morphologischen Eigenschaften des Knochenminerals.13
Bei Niedrigtemperaturbehandlung behält das Knochenmineral sowohl die natürliche Zusammensetzung des Carbonatapatits, als auch die natürliche Morphologie (Oberflächenstruktur und Porosität) und somit die große strukturelle Ähnlichkeit zum natürlichen Knochen. SMARTGRAFT wird, wie der bisherige Standard der bovinen KEM, mit Temperaturen unter dem Sinterpunkt behandelt.
*. Sinterung (Hochtemperatur)
Bei der Anwendung von höheren Temperaturen, wie es bei zahlreichen angebotenen KEM der Fall ist, wird das Knochenmineral zwar zunehmend stabiler, allerdings erfolgt eine „Sinterung“ der Mineralkristalle. Dies führt zu einer signifikanten Änderung der Morphologie, einer Glättung der Oberfläche, sowie dem Verlust von Mikro- und Nanoporosität.1,13 Zudem wird das Carbonat aus der Knochenmatrix entfernt.1
Neben der Herstellungsmethodik hat auch die Herkunft des Gewebes einen großen Einfluss auf die Materialeigenschaften. Aufgrund seines porcinen Ursprungs besitzt SMARTGRAFT eine größere Ähnlichkeit zu humanem Knochen als vergleichbare Präparate bovinen Ursprungs.1,2 Dies bringt optimale Voraussetzungen für verbesserte Biokompatibilität und Regenerationsfähigkeit mit sich.
LITERATUR
- Kolk A et al. J CMF Surg 2012;40:705-718.
- Kao ST et al. Oral Maxillofac Surg Clin North Am 2007;19: 513-521.
- Kübler NR. Mund Kiefer Gesichtschir 1997;1:2-25.
- Schenk RK. In: Huggler AH, Kuner EH (Hrsg): Aktueller Stand beim Knochenersatz, Hefte zur Unfallheilkunde 216. Berlin Heidelberg New York, 1991:23-35.
- Chang BS, Lee CK, Hong KS, Youn HJ, Ryu HS, Chung SS, Park KW. Biomaterials. 2000;21:1291-1298.
- Flautre B et al. J. Mater. Sci. Mater. Med. 2001;12:679-682.
- Dorozhkin SV. BIO 2011;1:1-51.
- Burchardt H. Orthop Clin North Am 1987;18:187-196.
- Buckwalter JA et al. Instr Course Lect 1996;45:371-386.
- Katthagen BD. In: Pesch H J, Stöss H,Kummer B (Hrsg): Osteologie Aktuell VII, Springer, Berlin Heidelberg New York, 1993:151-153.
- Kim YJ et al. Int J Dent. 2020 Feb 19;2020:2494128.
- Fretwurst T et al. Oral Surg Oral Med Oral Pathol Oral Radiol 2014;118:424-431.
- Figueiredo M et al. Ceramics International 2010;36:2383–2393.
- Thorwarth M et al. British Journal of Oral and Maxillofacial Surgery. 2007;45:41–47.
- Maiorana C et al. Int J Periodontics Restorative Dent. 2005;25:19–25.
- Aghaloo TL et al. Int J Oral Maxillofac Implants. 2007;22 Suppl:49-70.
- Sanz-Sánchez I et al. 2015;doi:10.1177/0022034515594780.
- Jung RE et al. Clin Oral Implants Res. 2013;24(10):1065-1073.
- Pearce A et al. European Cells and Materials 2007;13:1-10.
- Data on file, Shu-Thung Li et al. Science, Technology, Innovation, Aug. 2014: 1–13.
- Lee JH et al. J Periodontal Implant Sci. 2017;47(6):388-401.
- Tadic T et al. Biomaterials 2004;25:987–994.
- Vanis S et al. Mat.-wiss. U. Werkstofftech. 2006;37(6):469-473.
- Kim Y et al.. Clin Implant Dent Relat Res 2013;15(5):645-653.
DOWNLOAD-BEREICH
| Broschüre SMARTGRAFT |
OSSIX® VOLUMAX
Volumenstabile Zucker-vernetzte Kollagenmatrix
OSSIX® Volumax ist eine volumenstabile Kollagenmatrix auf Basis von Zucker-vernetztem, hoch aufgereinigtem porcinem Kollagen.
Aufgrund ihrer besonderen Eigenschaften ergeben sich mit der OSSIX® Volumax erweiterte Therapieoptionen, die über das klassische Einsatzspektrum einer Barrieremembran hinausgehen.
Die ca. 2 mm dicke OSSIX® Volumax (OV) besitzt eine Leitschienenfunktion zur Knochenneubildung.1,2 Somit können kleine Knochendefekte mit OV auch ohne die zusätzliche Verwendung von Knochenersatzmaterial behandelt werden.
Die Augmentation ist mit weitaus weniger invasiven Lappentechniken als bei klassischen GBR-Protokollen möglich, da die Matrix mit einem vereinfachten chirurgischen Protokoll zwischen den ortsständigen Knochen und dem Mukoperiostlappen platziert werden kann.

Struktur der OSSIX® Volumax-Kollagenmatrix: Kollagenfaserstruktur an der Membranoberfläche als Voraussetzung für das Attachment und die Proliferation von Zellen und Blutgefäßen (oben rechts). Poröser Matrixkörper im Querschnitt zum optimalen zellulären Durchbau (unten rechts).
VORTEILE
ZUVERLÄSSIGE MATRIXFUNKTION
Zucker-vernetzte Kollagenstruktur fördert schnellen Gewebeeinbau und ermöglicht kontrollierten Umbau zu körpereigenem Gewebe.
Durch den physiologischen GLYMATRIX®-Prozess erhält OSSIX® Volumax ihre biokompatible vernetzte Kollagenstruktur.
Die Konfiguration der OSSIX® Volumax-Matrix (OV) wurde im Vergleich zur etablierten OSSIX® Plus-Membran (OP) in drei wesentlichen Punkten angepasst:- OV ist mit ca. 2,0 mm signifikant dicker als die OP (0,2mm). Durch Rehydratisierung erfolgt eine kleine zusätzliche Expansion.
- OV ist weniger kondensiert und weist eine offenere Kollagenfaserstruktur als die OP auf.
- OV besitzt mehrere Schichten mit unterschiedlicher Faserdichte

Der Querschnitt durch OSSIX® Volumax zeigt dichtes Fasernetzwerk gepaart mit einer porösen Matrixstruktur.
Das hochreine konservierte Matrixkollagen spielt eine wichtige Rolle für die Blutgerinnung und fördert Zelladhäsion, Mineralablagerung sowie die Knochenneubildung.3 Durch das langsame Biodegradationsprofil des kreuzvernetzten Kollagens dient der OSSIX® Volumax-Matrixkörper nach der Implantation als Leitschiene für den Körper zur Gewebeneubildung.1
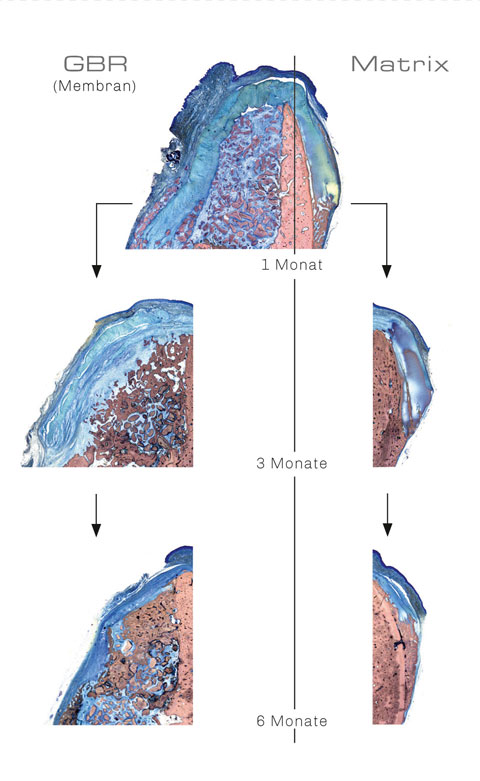
In einer in vivo-Untersuchung (Beagle Hunde) konnte gezeigt werden, dass OSSIX® Volumax über die Zeit hinweg in die benachbarten Gewebe integriert wird und so die Wiederherstellung der Defekte fördert.
In Kontakt mit ortsständigem Knochen wurde bereits nach einem Monat eine signifikante Mineralisierung des OV-Matrixkörpers beobachtet.
Im weiteren Verlauf wurde die OSSIX® Volumax-Matrix durch einen zellulären Prozess zu neuem vitalen Knochen umgebaut.1
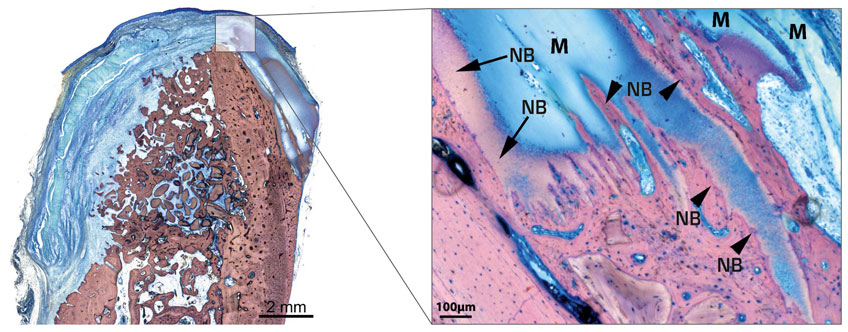
Histologische Evaluation des knöchernen Integrationsvorgangs des OSSIX® Volumax-Matrixkörpers nach 3 Monaten post-OP (Hunde-Modell).
NB = Neu gebildeter Knochen / M = OSSIX® Volumax.
ERWEITERTE THERAPIEMÖGLICHKEITEN
Stabiles Matrixgerüst zur Erweiterung des GBR-Einsatzspektrums
Durch den physiologischen Kreuzvernetzungsprozess und ihre Stärke von ca. 2,0 mm besitzt die OSSIX® Volumax ein außerordentlich langes Biodegradationsprofil von 10 bis 12 Monaten bei gleichermaßen hoher Biokompatibilität.1
Dadurch kann sie als effektive Barrieremembran in der regenerativen Chirurgie eingesetzt werden, speziell in anspruchsvoller Indikationsstellung.
Nach Implantation wird das durch Zucker-kreuzvernetzte Kollagen der OSSIX® Volumax vom Körper nicht im klassischen Sinne resorbiert, wie es bei einigen nativen Kollagenmembranen der Fall ist.2,3 Vielmehr fungiert das Präparat als Matrix für den Gewebeneuaufbau. Durch diese Leitschienenfunktion bietet OSSIX® Volumax erweiterte Therapieoptionen für einen gesteuerten Gewebeaufbau im Vergleich zu einer klassischen Kollagenmembran:
Sie kann auch für die alleinige Gewebeaugmentation ohne zusätzliches Knochenersatzmaterial eingesetzt werden.
In einer in vivo-Untersuchung wurden L-förmige Defekte in Beagle Hunden mit einer Kombination eines langsam resorbierenden Knochenersatzmaterials und der OSSIX® Volumax-Matrix behandelt. Die Kollagenmatrix wurde einerseits als Barriere zur Abdeckung des mit KEM gefüllten L-förmigen Defekts eingesetzt (GBR-Setup). Zudem wurde OSSIX® Volumax über den Knochendefekt hinaus im lingualen Aspekt unter den abgehobenen Mukoperiostlappen als Gewebeleitschiene direkt auf dem ortsständigen Knochen platziert (Matrix-Setup).
Im GBR-Setup weist die OSSIX® Volumax eine wirksame Membran- / Barrierefunktion für mindestens 6 Monate auf und fördert so die Wiederherstellung der aufgefüllten Defekte.
Im alleinigen Augmentationssetting (Matrix) konnte histologisch gezeigt werden, dass OSSIX® Volumax bei Kontakt zu ortsständigem Knochen über die Zeit hinweg mineralisiert und so durch einen zellulären Prozess zu neuem vitalen Knochen umgebaut wird (Ossifikation).1
Daher hat OSSIX® Volumax das Potential, dünnes Gewebe um Implantate, ästhetische Mängel und knöcherne Restdehiszenzen nach regenerativen Verfahren zu korrigieren.
Verschiedene Applikationsmöglichkeiten der OSSIX® Volumax-Matrix für den gesteuerten Gewebeaufbau: Zur Abdeckung von Knochenersatzmaterial (li) oder als Kollagenmatrix zur alleinigen Augmentation kleiner Gewebedefekte ohne zusätzliche Verwendung von KEM (re).
VEREINFACHTES CHIRURGISCHES PROTOKOLL
Optimale Adaption und Anliegeeigenschaften ermöglichen vereinfachte Applikation
OSSIX® Volumax ist eine Kollagenmatrix mit ca. 2,0 mm Stärke. Nach der Rehydratisierung expandiert die Kollagenmatrix etwas und weist dann eine angenehm adaptierbare Konsistenz auf.
Dadurch adhäriert OSSIX® Volumax einfach und zeitsparend auf knöchernen Oberflächen und vereinfacht so die Applikation der Kollagenmatrix.
Insbesonders die Augmentation von kleinen Gewebedefekten, die mit OSSIX® Volumax alleine ohne die zusätzliche Verwendung von KEM durchgeführt werden kann, ist mit weitaus weniger invasiven Lappentechniken möglich, da die Matrix mit einem vereinfachten chirurgischen Protokoll zwischen dem ortsständigen Knochen und dem Mukoperiostlappen platziert werden kann.
Optimale Adhäsion und Adaption der OSSIX® Volumax auf knöchernen Oberflächen.
PRODUKTE

| Artikelnummer | Membrangröße | |
| 0144.207 | 10mm x 12,5mm | |
| 0144.205 | 15mm x 25mm | |
| 0144.204 | 25mm x 30mm |
INDIKATIONEN
OSSIX® Volumax – erweiterte Therapieoptionen

Aufgrund ihrer besonderen Eigenschaften ergeben sich mit der OSSIX® Volumax erweiterte Therapieoptionen, die über das klassische Einsatzspektrum einer Barrieremembran hinausgehen.
| Bukkale / Laterale Konturaugmentation |  |
|
| Implantation mit simultaner Knochenaugmentation |  |
KLINISCHE EVIDENZ
TECHNOLOGIE
Kollagen-Kreuzvernetzung
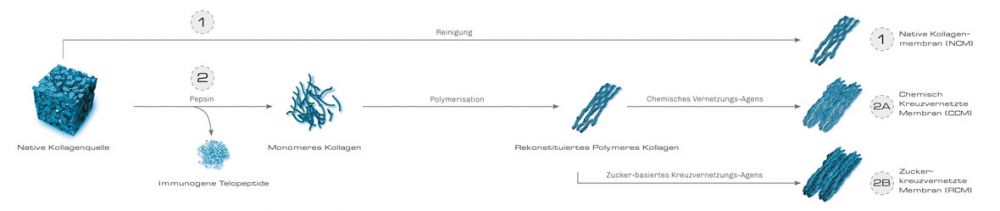
1. Native Kollagenmembranen
Für die Herstellung wird ein passendes natives Kollagengewebe einem gründlichen physikalischen und chemischen Reinigungsvorgang unterzogen und abschließend sterilisiert. Der Vorgang soll die natürliche Struktur und Stabilität des Ausgangsmaterials erhalten. Biomechanik und Resorptionsprofil sind daher vor allem von den Eigenschaften des nativen Gewebes abhängig.
Ausgangsmaterial für die Herstellung nativer Kollagenmembranen ist meist ein Gewebe mit einer entsprechenden dreidimensionalen Stabilität, zum Beispiel Perikard oder Peritoneum. Das Resorptionsprofil (Barrierefunktion im Zeitverlauf) wird durch den Vernetzungsgrad des Kollagens im jeweiligen nativen Gewebe beschränkt.
2. Kreuzvernetzte Membranen
Neben der physikalischen und chemischen Reinigung werden kreuzvernetzte Kollagenmembranen noch einem zusätzlichen biochemischen Aufreinigungsvorgang unterzogen. Durch eine Enzymbehandlung, z. B. mit Pepsin, wird das Kollagen in den monomeren Zustand zurückversetzt.
Dies ermöglicht die effiziente Entfernung der potentiell immunogenen Telopeptide im nativen Kollagen.
Jedoch gehen durch diese Behandlung die natürliche Kreuzvernetzung des Kollagens und die physikalische Struktur und Barrierefunktion des nativen Kollagengewebes vollständig verloren.
Durch Zugabe eines passenden Vernetzungsmittels können aus dem aufgereinigten monomeren Kollagen wieder Membranen hergestellt werden. Das physikalische Verhalten sowie das Resorptionsprofil lassen sich durch den Vernetzungsgrad nach Wunsch anpassen.17
Im Vergleich zur Herstellung nativer Kollagenmembranen hat diese Methode den Vorteil, dass sich so Membranen mit längeren Resorptionsprofilen herstellen lassen.
2a. Chemisch kreuzvernetzte Membranen
Die chemische Behandlung stellt die gängigste Methode der Vernetzung dar. Leider ist das Vernetzen von Kollagenmembranen aufgrund der hohen Toxizität der verwendeten Chemikalien häufig mit verringerter Biokompatibilität im Vergleich mit nativen Kollagenmembranen verbunden.17,18
2b. Zucker-kreuzvernetzte Membranen
Moderne Techniken zur Kreuzvernetzung von Kollagen basieren auf natürlichen Zuckern, z.B. Ribose.
Nach einem physiologischen Vorgang, der der natürlich auftretenden Glykierung im menschlichen Körper entspricht, kann ein hoher Vernetzungsgrad erreicht werden, ohne die Biokompatibilität des nativen Kollagens zu beeinträchtigen. Zucker-kreuzvernetzte Membranen weisen daher sowohl ein verlängertes Barriereprofil als auch eine hohe Biokompatibilität auf.
Die OSSIX® Volumax-Membran wird nach dieser patentierten Technologie (GLYMATRIX®) hergestellt.
LITERATUR
- Zubery Y, Goldlust A, Bayer T, Woods S, Jackson N, Soskolne WA. AAP 2016:P125.
- Zubery Y, Nir E, Goldlust A. Ossification of a collagen membrane cross-linked by sugar: a human case series. J Periodontol. 2008;79(6):1101-1107.
- Brett D. A Review of Collagen and Collagen-based Wound Dressings. Wounds. 2008;20(12).